2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
三、滴定曲线
以滴加______为横坐标,以______为纵坐标绘出一条溶液pH随酸(或碱)的滴加量而变化的曲线。如图所示为用0.1000 mol·L⁻¹ NaOH溶液滴定20.00 mL 0.1000 mol·L⁻¹ HCl溶液过程中的pH变化曲线。

由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,有利于确定滴定终点。
以滴加______为横坐标,以______为纵坐标绘出一条溶液pH随酸(或碱)的滴加量而变化的曲线。如图所示为用0.1000 mol·L⁻¹ NaOH溶液滴定20.00 mL 0.1000 mol·L⁻¹ HCl溶液过程中的pH变化曲线。

由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,有利于确定滴定终点。
答案:
酸(或碱)的量 溶液pH
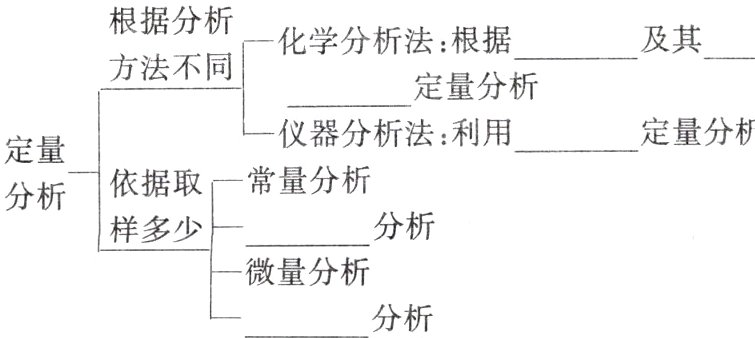
1. 定性分析
定性分析用来确定物质的______,包括元素、无机物所含的______和有机物所含的______等;
定性分析主要包括试样的______和准备、初步实验、阳离子分析和阴离子分析等。
定性分析用来确定物质的______,包括元素、无机物所含的______和有机物所含的______等;
定性分析主要包括试样的______和准备、初步实验、阳离子分析和阴离子分析等。
答案:
成分 离子 官能团 外表观察
2. 定量分析
定量分析测定物质中元素、离子、官能团等各成分的含量;
定量分析测定物质中元素、离子、官能团等各成分的含量;

答案:
化学反应 计量关系 特定仪器 半微量 超微量
1. 某同学取20.00 mL 0.50 mol·L⁻¹ NaOH溶液,恰好将未知浓度的H₂SO₄溶液20.00 mL滴定至终点,下列说法正确的是 ( )
A. 该实验不需要指示剂
B. 用量筒量取上述硫酸的体积
C. H₂SO₄的浓度为1.00 mol·L⁻¹
D. 参加反应的H⁺和OH⁻的物质的量相等
A. 该实验不需要指示剂
B. 用量筒量取上述硫酸的体积
C. H₂SO₄的浓度为1.00 mol·L⁻¹
D. 参加反应的H⁺和OH⁻的物质的量相等
答案:
D 酸碱中和滴定需要指示剂,A项错误;量筒的精确度为0.1 mL,应用酸式滴定管量取20.00 mL硫酸,B项错误;$n(\mathrm{H}_{2}\mathrm{SO}_{4}) = n(\mathrm{H}^{+})\times\frac{1}{2}=n(\mathrm{NaOH})\times\frac{1}{2}=5\times10^{-3}\mathrm{mol}$,$c(\mathrm{H}_{2}\mathrm{SO}_{4}) = 0.25\mathrm{mol}\cdot\mathrm{L}^{-1}$,C项错误;恰好完全反应时$n(\mathrm{H}^{+}) = n(\mathrm{OH}^{-})$,D项正确。
2. 用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是 ( )
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量指示剂进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量指示剂进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
答案:
C 滴定管使用前要用标准盐酸润洗,A项错误;锥形瓶不能用氢氧化钠溶液润洗,B项错误;锥形瓶中加入蒸馏水,不影响结果,C项正确;用酚酞作指示剂滴至红色变无色,且半分钟不变色,才到终点,D项错误。
3. 如图是常温下向20.0 mL的盐酸中逐滴加入0.10 mol·L⁻¹ NaOH溶液时,溶液的pH随NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是 ( )
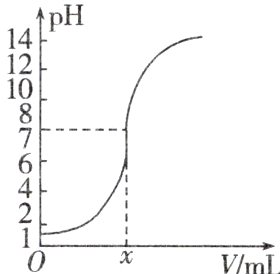
A. 原盐酸的浓度为0.10 mol·L⁻¹
B. x的值为2.0
C. pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L⁻¹

A. 原盐酸的浓度为0.10 mol·L⁻¹
B. x的值为2.0
C. pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L⁻¹
答案:
A 当$V(\mathrm{NaOH}) = 0\mathrm{mL}$时,盐酸的pH = 1,因此$c(\mathrm{HCl}) = 0.10\mathrm{mol}\cdot\mathrm{L}^{-1}$;当反应后溶液pH = 7时,HCl与NaOH恰好完全反应,因此$n(\mathrm{HCl}) = n(\mathrm{NaOH})$,故$V(\mathrm{NaOH}) = 20.0\mathrm{mL}$;当反应后溶液pH = 12时,$V(\mathrm{NaOH})\approx24.4\mathrm{mL}$。
4. 如图曲线a和b是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )
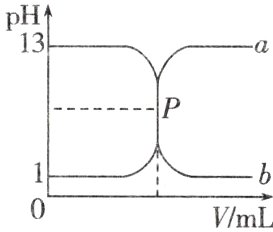
A. 盐酸的物质的量浓度为1 mol/L
B. P点时恰好完全中和,溶液呈中性
C. 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D. 酚酞不能用作本实验的指示剂

A. 盐酸的物质的量浓度为1 mol/L
B. P点时恰好完全中和,溶液呈中性
C. 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D. 酚酞不能用作本实验的指示剂
答案:
B 由图可知,盐酸与氢氧化钠溶液的浓度相等,都是0.1 mol/L,A错误;P点时盐酸与氢氧化钠溶液的体积相等,恰好完全中和,溶液呈中性,故B项正确;曲线a对应的溶液起点的pH等于1,故曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,C项错误;强酸和强碱的中和滴定,达到终点时溶液为中性,指示剂选择酚酞或甲基橙都可以,D项错误。
查看更多完整答案,请扫码查看


