2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
11.氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。用氢气和氮气合成氨是一个可逆反应,化学方程式为$N₂+3H₂\underset{高温、高压 }{\overset{催化剂}{\rightleftharpoons }}2NH₃$。已知,在常温下,1 g H₂完全转化为NH₃,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式:____________________
______________________________。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=-198.2 J·mol⁻¹·K⁻¹,则其在常温下______(填“能”或“不能”)自发进行。
(1)请写出该反应的热化学方程式:____________________
______________________________。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=-198.2 J·mol⁻¹·K⁻¹,则其在常温下______(填“能”或“不能”)自发进行。
答案:
解析:
(2)ΔH - TΔS = - 92.4 kJ·mol⁻¹ - 298 K×(- 0.1982 kJ·mol⁻¹·K⁻¹)<0,所以常温下该反应可以自发进行。
答案:
(1)N₂(g) + 3H₂(g)⇌2NH₃(g)
ΔH = - 92.4 kJ·mol⁻¹
(2)能
(2)ΔH - TΔS = - 92.4 kJ·mol⁻¹ - 298 K×(- 0.1982 kJ·mol⁻¹·K⁻¹)<0,所以常温下该反应可以自发进行。
答案:
(1)N₂(g) + 3H₂(g)⇌2NH₃(g)
ΔH = - 92.4 kJ·mol⁻¹
(2)能
12.下列对化学反应预测正确的是 ( )


答案:
B 根据复合判据:ΔG = ΔH - TΔS,M(s)⇌X(g) + Y(s),固体分解生成气体,为熵增反应,ΔH>0时,在高温下,能自发进行,A错误;W(s) + xG(g)⇌2Q(g) ΔH<0,能自发进行,若熵增,任何温度下都能自发进行,若熵减,在低温条件下能自发进行,所以,G的计量数不确定,x等于1、2或3时,都符合题意,B正确;4X(g) + 5Y(g)⇌4W(g) + 6G(g)是熵增反应,当ΔH>0时,在高温下可能自发进行,C错误;4M(s) + N(g) + 2W(l)⇌4Q(s)为熵减反应,常温下能自发进行,说明该反应一定是放热反应,ΔH<0,D错误。
13.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知在0℃、100 kPa条件下白锡转化为灰锡的反应焓变和熵变分别为ΔH=-2180.9 J·mol⁻¹,ΔS=-6.61 J·mol⁻¹·K⁻¹) ( )
A.会变
B.不会变
C.不能确定
D.升高温度才会变
A.会变
B.不会变
C.不能确定
D.升高温度才会变
答案:
A 在等温、等压条件下,自发反应总是向着ΔH - TΔS<0的方向进行,直至达到平衡状态。因此,在0℃、100 kPa条件下,白锡会不会变为灰锡的问题就转化为求算反应白锡→灰锡的ΔH - TΔS的值的问题。ΔH - TΔS = - 2180.9 J·mol⁻¹ - 273 K×(- 6.61 J·mol⁻¹·K⁻¹) = - 376.37 J·mol⁻¹<0,因此在该条件下白锡会变为灰锡。
14.汽车尾气(含烃类、CO、NO与SO₂等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)===N₂(g)+2CO₂(g),在298 K、100 kPa下,ΔH=-113 kJ·mol,ΔS=-145 J(mol·K)。下列说法中错误的是 ( )
A.该反应中反应物总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,高温和催化剂条件只是加快反应的速率
D.汽车尾气中的这两种气体会与人体血红蛋白结合而使人中毒
A.该反应中反应物总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,高温和催化剂条件只是加快反应的速率
D.汽车尾气中的这两种气体会与人体血红蛋白结合而使人中毒
答案:
B 由已知得反应为放热反应,且是熵减的反应。生成物的总能量低于反应物的总能量,常温ΔH - TΔS = - 113 kJ/mol - 298 K×[- 145×10⁻³ kJ/(mol·K)] = - 69.79 kJ/mol<0,即该反应在常温下能自发进行,故A、C、D正确。
15.反应CH₃OH(l)+NH₃(g)===CH₃NH₂(g)+H₂O(g)在高温下自发向右进行,若反应|ΔH|=17 kJ·mol⁻¹,|ΔH-TΔS|=17 kJ·mol⁻¹,则下列判断正确的是 ( )
A.ΔH>0 ΔH-TΔS<0
B.ΔH<0 ΔH-TΔS>0
C.ΔH>0 ΔH-TΔS>0
D.ΔH<0 ΔH-TΔS<0
A.ΔH>0 ΔH-TΔS<0
B.ΔH<0 ΔH-TΔS>0
C.ΔH>0 ΔH-TΔS>0
D.ΔH<0 ΔH-TΔS<0
答案:
A 该反应在一定温度下能够自发向右进行,这说明ΔH - TΔS一定是小于0,根据方程式可知该反应的ΔS>0,所以如果ΔH<0,则该反应在任何温度下都是自发进行的,而该反应在高温下能够自发向右进行,因此该反应的反应热ΔH>0。
16.(1)工业上合成甲醇的反应原理为CO(g)+2H₂(g)⇌CH₃OH(g) ΔH,如表所列数据是该反应在不同温度下的化学平衡常数(K)。
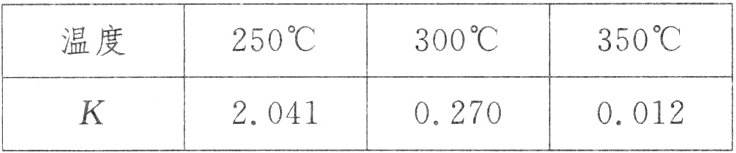
根据表中数据可判断ΔH______0(填“>”“=”或“<”),此反应______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)甲醇水蒸气重整制氢是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当前研究主要集中在提高催化剂活性和降低尾气中CO含量以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应Ⅰ.CH₃OH(g)+H₂O(g)⇌CO₂(g)+3H₂(g) ΔH₁
反应Ⅱ.CH₃OH(g)⇌CO(g)+2H₂(g) ΔH₂
反应Ⅲ.CO(g)+H₂O(g)⇌CO₂(g)+H₂(g) ΔH₃
其对应的平衡常数分别为K₁、K₂、K₃,其中K₂、K₃随温度变化如表所示:

请回答:
反应Ⅱ能够自发进行的条件是______(填“低温”“高温”或“任何温度”),ΔH₁______ΔH₃(填“>”“<”或“=”)。

根据表中数据可判断ΔH______0(填“>”“=”或“<”),此反应______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)甲醇水蒸气重整制氢是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当前研究主要集中在提高催化剂活性和降低尾气中CO含量以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应Ⅰ.CH₃OH(g)+H₂O(g)⇌CO₂(g)+3H₂(g) ΔH₁
反应Ⅱ.CH₃OH(g)⇌CO(g)+2H₂(g) ΔH₂
反应Ⅲ.CO(g)+H₂O(g)⇌CO₂(g)+H₂(g) ΔH₃
其对应的平衡常数分别为K₁、K₂、K₃,其中K₂、K₃随温度变化如表所示:

请回答:
反应Ⅱ能够自发进行的条件是______(填“低温”“高温”或“任何温度”),ΔH₁______ΔH₃(填“>”“<”或“=”)。
答案:
解析:
(1)由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即ΔH<0,根据反应自发进行的判据:ΔH - TΔS<0。得到此反应较低温度下有利于该反应自发进行;
(2)当温度升高时,反应Ⅱ的化学平衡常数K₂也增大,说明温度升高有利于反应Ⅱ正向进行,则反应Ⅱ为吸热反应,其焓变ΔH₂>0,反应Ⅱ为气体分子数增多的反应,随着反应进行,体系混乱度增大,则反应Ⅱ的ΔS₂>0,所以反应Ⅱ自发进行的条件是高温,反应Ⅱ可由反应Ⅰ - 反应Ⅲ得到,根据盖斯定律,ΔH₂ = ΔH₁ - ΔH₃,由于ΔH₂>0,所以ΔH₁>ΔH₃。
答案:
(1)< 较低
(2)高温 >
(1)由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即ΔH<0,根据反应自发进行的判据:ΔH - TΔS<0。得到此反应较低温度下有利于该反应自发进行;
(2)当温度升高时,反应Ⅱ的化学平衡常数K₂也增大,说明温度升高有利于反应Ⅱ正向进行,则反应Ⅱ为吸热反应,其焓变ΔH₂>0,反应Ⅱ为气体分子数增多的反应,随着反应进行,体系混乱度增大,则反应Ⅱ的ΔS₂>0,所以反应Ⅱ自发进行的条件是高温,反应Ⅱ可由反应Ⅰ - 反应Ⅲ得到,根据盖斯定律,ΔH₂ = ΔH₁ - ΔH₃,由于ΔH₂>0,所以ΔH₁>ΔH₃。
答案:
(1)< 较低
(2)高温 >
查看更多完整答案,请扫码查看


