2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第2页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
[判一判]
(1)化学变化中的能量变化都是化学能与热能间的相互转化 ( )
(2)所有的化学反应都伴有能量的变化 ( )
(3)加热条件下发生的反应均为吸热反应 ( )
(4)浓硫酸溶于水,体系的温度升高,该过程属于放热反应 ( )
(5)石墨转化为金刚石需要吸收能量,所以石墨更稳定 ( )
(1)化学变化中的能量变化都是化学能与热能间的相互转化 ( )
(2)所有的化学反应都伴有能量的变化 ( )
(3)加热条件下发生的反应均为吸热反应 ( )
(4)浓硫酸溶于水,体系的温度升高,该过程属于放热反应 ( )
(5)石墨转化为金刚石需要吸收能量,所以石墨更稳定 ( )
答案:
(1)×
(2)√
(3)×
(4)×
(5)√
(1)×
(2)√
(3)×
(4)×
(5)√
1. 下列物质放入水中,体系向环境释放热量的是 ( )
A. 食盐
B. 蔗糖
C. 酒精
D. 生石灰
A. 食盐
B. 蔗糖
C. 酒精
D. 生石灰
答案:
D 生石灰与水的反应属于放热反应,反应体系向环境释放热量。
2. 下列反应既属于放热反应,又属于氧化还原反应的是 ( )
A. Ba(OH)₂溶液与硫酸溶液反应
B. 铝片与稀硫酸反应
C. 灼热的炭与CO₂反应
D. NH₄NO₃固体与Ba(OH)₂·8H₂O晶体反应
A. Ba(OH)₂溶液与硫酸溶液反应
B. 铝片与稀硫酸反应
C. 灼热的炭与CO₂反应
D. NH₄NO₃固体与Ba(OH)₂·8H₂O晶体反应
答案:
B A不是氧化还原反应;B既是放热反应,又是氧化还原反应,所以符合题意;C为吸热反应;D为吸热反应,而且是非氧化还原反应。
3. 利用如图装置测定中和反应反应热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L⁻¹硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L⁻¹ NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是____________________。
(2)使硫酸与NaOH溶液混合均匀的正确操作是____________________。

①用量筒量取50 mL 0.25 mol·L⁻¹硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L⁻¹ NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是____________________。
(2)使硫酸与NaOH溶液混合均匀的正确操作是____________________。
答案:
解析:
(1)倒入氢氧化钠溶液时,必须一次迅速倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果。
(2)使硫酸与NaOH溶液混合均匀的正确操作方法是用套在温度计上的玻璃搅拌棒轻轻地搅动。
答案:
(1)一次迅速倒入
(2)用套在温度计上的玻璃搅拌棒轻轻地搅动
(1)倒入氢氧化钠溶液时,必须一次迅速倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果。
(2)使硫酸与NaOH溶液混合均匀的正确操作方法是用套在温度计上的玻璃搅拌棒轻轻地搅动。
答案:
(1)一次迅速倒入
(2)用套在温度计上的玻璃搅拌棒轻轻地搅动
4. 下列说法正确的是 ( )
A. 反应热是1 mol物质参加反应时的能量变化
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定
A. 反应热是1 mol物质参加反应时的能量变化
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定
答案:
D 在化学反应过程中放出或吸收的热量,通常叫反应热,此时参加反应的物质的量不一定是1 mol,故A错误;当反应放热时ΔH<0,反应吸热时ΔH>0,故B错误;在等压条件下,反应的ΔH(焓变)等于反应热,故C错误;对于一个化学反应,生成物与反应物的焓值差即焓变决定了反应是吸热还是放热,故D正确。
5. 已知某化学反应X(g)+2Y(g)═2Z(g),反应中的能量变化如图所示,下列有关该反应的说法正确的是 ( )
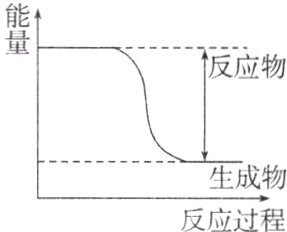
A. 该反应是吸热反应
B. 反应物的总键能小于生成物的总键能
C. Y的能量高于Z的能量
D. 该反应的反应热ΔH>0

A. 该反应是吸热反应
B. 反应物的总键能小于生成物的总键能
C. Y的能量高于Z的能量
D. 该反应的反应热ΔH>0
答案:
B 该反应中反应物的总能量高于生成物的总能量,故该反应是放热反应,其焓变小于0,A、D项错误;放热反应中反应物的总键能小于生成物的总键能,B项正确;反应物的总能量高于生成物的总能量,C项错误。
6. 已知:
①4NH₃(g)+3O₂(g)═2N₂(g)+6H₂O(g) ΔH = - 1269 kJ/mol
②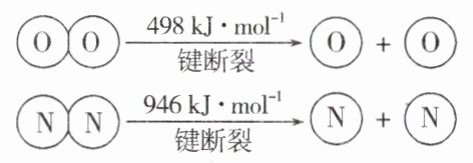
下列说法正确的是 ( )
A. 断开1 mol O - O键比断开1 mol N - N键所需能量少448 kJ
B. 断开1 mol H - O键与断开1 mol H - N键所需能量相差约72.6 kJ
C. 由以上键能的信息可知H₂O的沸点比NH₃高
D. 由元素非金属性的强弱可知H - O键的稳定性比H - N键弱
①4NH₃(g)+3O₂(g)═2N₂(g)+6H₂O(g) ΔH = - 1269 kJ/mol
②

下列说法正确的是 ( )
A. 断开1 mol O - O键比断开1 mol N - N键所需能量少448 kJ
B. 断开1 mol H - O键与断开1 mol H - N键所需能量相差约72.6 kJ
C. 由以上键能的信息可知H₂O的沸点比NH₃高
D. 由元素非金属性的强弱可知H - O键的稳定性比H - N键弱
答案:
B 根据②可知断开1 mol O = O键比断开1 mol N≡N键所需能量少448 kJ,A项错误;由已知得12E(H - N)+3×498 kJ/mol - 2×946 kJ/mol - 12E(H - O)= - 1269 kJ/mol,即E(H - O)-E(H - N)≈72.6 kJ/mol,所以断开1 mol H - O键与断开1 mol H - N键所需能量相差约72.6 kJ,B项正确;物质的沸点与键能大小无关,而与分子间作用力有关,C项错误;元素的非金属性越强,与H元素形成的化学键越稳定,由于非金属性:O>N,则H - O键比H - N键的稳定性强,D项错误。
查看更多完整答案,请扫码查看


