2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
13.硫酸锶(SrSO₄)在水中的沉淀溶解平衡曲线如下图所示,下列说法正确的是( )
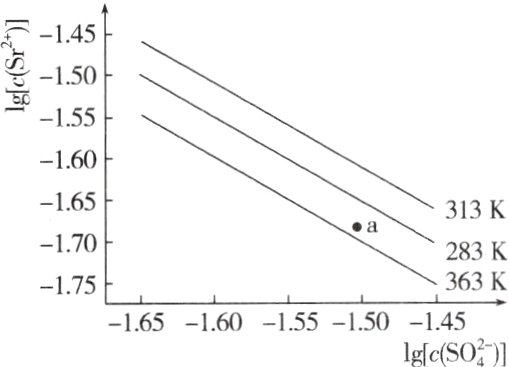
A.温度一定时,Kₛₚ(SrSO₄)随c(SO₄²⁻)的增大而减小
B.三个不同温度中,313 K时Kₛₚ(SrSO₄)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO₄饱和溶液升温到363 K后变为不饱和溶液

A.温度一定时,Kₛₚ(SrSO₄)随c(SO₄²⁻)的增大而减小
B.三个不同温度中,313 K时Kₛₚ(SrSO₄)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO₄饱和溶液升温到363 K后变为不饱和溶液
答案:
B 温度一定时,Kₛₚ(SrSO₄)不变,A错误;由题中沉淀溶解平衡曲线可看出,313 K时,c(Sr²⁺)、c(SO₄²⁻)最大,Kₛₚ最大,B正确;283 K时,a点c(Sr²⁺)小于平衡时c(Sr²⁺),故未达到饱和,沉淀继续溶解,C不正确;从283 K升温到363 K要析出固体,依然为饱和溶液,D错误。
14.还原沉淀法是处理含铬(Cr₂O₇²⁻和CrO₄²⁻)废水常用方法,过程如下:
CrO₄²⁻→(H⁺)Cr₂O₇²⁻→(Fe²⁺)Cr³⁺→(OH⁻)Cr(OH)₃
已知废水中Cr的含量为26.0 g·L⁻¹,当溶液中离子浓度小于10⁻⁵ mol·L⁻¹时认为离子已经沉淀完全,常温下,Kₛₚ[Cr(OH)₃]=1×10⁻³²。有关叙述中不正确的是( )
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为Cr₂O₇²⁻+14H⁺+6Fe²⁺=2Cr³⁺+7H₂O+6Fe³⁺
C.处理含铬废水可使用强碱Ba(OH)₂,也可以使用弱碱氨水
D.当pH≥5时,废水中铬元素沉淀完全
CrO₄²⁻→(H⁺)Cr₂O₇²⁻→(Fe²⁺)Cr³⁺→(OH⁻)Cr(OH)₃
已知废水中Cr的含量为26.0 g·L⁻¹,当溶液中离子浓度小于10⁻⁵ mol·L⁻¹时认为离子已经沉淀完全,常温下,Kₛₚ[Cr(OH)₃]=1×10⁻³²。有关叙述中不正确的是( )
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为Cr₂O₇²⁻+14H⁺+6Fe²⁺=2Cr³⁺+7H₂O+6Fe³⁺
C.处理含铬废水可使用强碱Ba(OH)₂,也可以使用弱碱氨水
D.当pH≥5时,废水中铬元素沉淀完全
答案:
C 第二步转化中Cr₂O₇²⁻与Fe²⁺反应生成Cr³⁺与Fe³⁺,Cr、Fe元素的化合价发生变化,属于氧化还原反应,故A正确;酸性条件下,Cr₂O₇²⁻与Fe²⁺发生氧化还原反应生成Cr³⁺和Fe³⁺,其反应的离子方程式为Cr₂O₇²⁻ + 14H⁺ + 6Fe²⁺ == 2Cr³⁺ + 7H₂O + 6Fe³⁺,故B正确;用强碱Ba(OH)₂调节pH会引入杂质Ba²⁺,Ba²⁺是重金属离子会污染水,故C错误;当溶液中离子浓度小于10⁻⁵ mol·L⁻¹时认为离子已经沉淀完全,当pH = 5时,溶液中c(OH⁻) = 10⁻⁹ mol·L⁻¹,则c(Cr³⁺) = $\frac{K_{sp}[Cr(OH)_{3}]}{c^{3}(OH^{-})}$ = $\frac{1×10^{-32}}{(1×10^{-9})^{3}}$ mol·L⁻¹ = 10⁻⁵ mol·L⁻¹,所以当pH ≥ 5时,c(Cr³⁺) ≤ 10⁻⁵ mol·L⁻¹,即废水中铬元素沉淀完全,故D正确。
15.变色镜片是在普通玻璃中加入了适量的溴化银和氧化铜的微晶粒。AgBr、AgI分别是难溶于水的淡黄色固体、黄色固体,已知常温下,AgBr的Kₛₚ=5.4×10⁻¹³、AgI的Kₛₚ=8.5×10⁻¹⁷。
(1)现向含有AgI的饱和溶液中:
①加入AgNO₃固体,则c(I⁻)________(填“变大”“变小”或“不变”,下同);
②若加入更多的AgI固体,则c(Ag⁺)________;
③若加入AgBr固体,则c(I⁻)________;而c(Ag⁺)________。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
A.两种难溶盐电解质,其中Kₛₚ小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Kₛₚ小的一定先生成沉淀
E.难溶盐电解质的Kₛₚ和温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度变小,也使Kₛₚ变小
(1)现向含有AgI的饱和溶液中:
①加入AgNO₃固体,则c(I⁻)________(填“变大”“变小”或“不变”,下同);
②若加入更多的AgI固体,则c(Ag⁺)________;
③若加入AgBr固体,则c(I⁻)________;而c(Ag⁺)________。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
A.两种难溶盐电解质,其中Kₛₚ小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Kₛₚ小的一定先生成沉淀
E.难溶盐电解质的Kₛₚ和温度有关
F.同离子效应(加入与原电解质具有相同离子的物质),使难溶盐电解质的溶解度变小,也使Kₛₚ变小
答案:
解析:
(1)①加入AgNO₃固体,使c(Ag⁺)增大,AgI溶解平衡向左移动,c(I⁻)变小。②加入更多的AgI固体,仍是该温度下的饱和溶液,各离子浓度不变。③因AgBr的溶解度大于AgI的溶解度,所以加入AgBr固体时,使c(Ag⁺)变大,而使AgI的溶解平衡向生成AgI的方向移动,c(I⁻)变小。
(2)A项中只有相同类型的难溶电解质,Kₛₚ越小,溶解度越小,不同类型的难溶电解质不能根据Kₛₚ判断溶解度的大小,A错误;B项中因温度不变,故再次达到平衡时,Kₛₚ与S均不变,B正确;Kₛₚ是各离子浓度的幂之积,C错误;D项中生成沉淀的先后还与离子的浓度有关,D错误;E正确;同离子效应不会改变Kₛₚ,F错误。
答案:
(1)①变小 ②不变 ③变小 变大
(2)BE
(1)①加入AgNO₃固体,使c(Ag⁺)增大,AgI溶解平衡向左移动,c(I⁻)变小。②加入更多的AgI固体,仍是该温度下的饱和溶液,各离子浓度不变。③因AgBr的溶解度大于AgI的溶解度,所以加入AgBr固体时,使c(Ag⁺)变大,而使AgI的溶解平衡向生成AgI的方向移动,c(I⁻)变小。
(2)A项中只有相同类型的难溶电解质,Kₛₚ越小,溶解度越小,不同类型的难溶电解质不能根据Kₛₚ判断溶解度的大小,A错误;B项中因温度不变,故再次达到平衡时,Kₛₚ与S均不变,B正确;Kₛₚ是各离子浓度的幂之积,C错误;D项中生成沉淀的先后还与离子的浓度有关,D错误;E正确;同离子效应不会改变Kₛₚ,F错误。
答案:
(1)①变小 ②不变 ③变小 变大
(2)BE
16.已知:25℃时,Kₛₚ[Mg(OH)₂]=3.2×10⁻¹¹,Kₛₚ[Cu(OH)₂]=2.2×10⁻²⁰,Kₛₚ[Fe(OH)₃]=2.6×10⁻³⁹,Kₛₚ[Al(OH)₃]=1.3×10⁻³³。
(1)①25℃时,向浓度均为0.1 mol·L⁻¹的MgCl₂和CuCl₂混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀。
②将MgCl₂、AlCl₃的混合溶液(A)与过量氨水(B)反应,为使Mg²⁺、Al³⁺同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)①25℃时,Fe³⁺发生水解反应Fe³⁺+3H₂O⇌Fe(OH)₃+3H⁺,该反应的平衡常数为________。
②25℃时,若向FeCl₃溶液中加入一定量的石灰水来调节溶液的pH,可得到红褐色沉淀。若调节后溶液的pH为5,则溶液中Fe³⁺的浓度为________。
(3)溶液中金属离子的物质的量浓度低于1.0×10⁻⁵ mol·L⁻¹时,可认为已沉淀完全。现向一定浓度的AlCl₃和FeCl₃的混合溶液中逐滴加入氨水,当Fe³⁺恰好完全沉淀时,测得c(Al³⁺)=0.2 mol·L⁻¹,此时所得沉淀中________(填“含有”或“不含有”)Al(OH)₃。
(1)①25℃时,向浓度均为0.1 mol·L⁻¹的MgCl₂和CuCl₂混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀。
②将MgCl₂、AlCl₃的混合溶液(A)与过量氨水(B)反应,为使Mg²⁺、Al³⁺同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)①25℃时,Fe³⁺发生水解反应Fe³⁺+3H₂O⇌Fe(OH)₃+3H⁺,该反应的平衡常数为________。
②25℃时,若向FeCl₃溶液中加入一定量的石灰水来调节溶液的pH,可得到红褐色沉淀。若调节后溶液的pH为5,则溶液中Fe³⁺的浓度为________。
(3)溶液中金属离子的物质的量浓度低于1.0×10⁻⁵ mol·L⁻¹时,可认为已沉淀完全。现向一定浓度的AlCl₃和FeCl₃的混合溶液中逐滴加入氨水,当Fe³⁺恰好完全沉淀时,测得c(Al³⁺)=0.2 mol·L⁻¹,此时所得沉淀中________(填“含有”或“不含有”)Al(OH)₃。
答案:
解析:
(1)①因为Kₛₚ[Mg(OH)₂] > Kₛₚ[Cu(OH)₂],生成Cu(OH)₂所需要的c(OH⁻)小于生成Mg(OH)₂所需要的c(OH⁻),因此先生成Cu(OH)₂沉淀。②若要使Mg²⁺、Al³⁺同时生成沉淀,则应先加入氨水。
(2)①K = $\frac{c^{3}(H^{+})}{c(Fe^{3+})}$ = $\frac{c^{3}(H^{+})·c^{3}(OH^{-})}{c(Fe^{3+})·c^{3}(OH^{-})}$ = $\frac{K_{w}^{3}}{K_{sp}[Fe(OH)_{3}]}$ = $\frac{(1.0×10^{-14})^{3}}{2.8×10^{-39}}$ ≈ 3.57×10⁻⁴。②pH = 5时,c(Fe³⁺) = $\frac{2.8×10^{-39}}{(10^{-9})^{3}}$ mol·L⁻¹ = 2.8×10⁻¹² mol·L⁻¹。
(3)Fe³⁺恰好完全沉淀时,c³(OH⁻) = $\frac{2.8×10^{-39}}{1.0×10^{-5}}$ mol³·L⁻³ = 2.8×10⁻³⁴ mol³·L⁻³,c(Al³⁺)·c³(OH⁻) = 0.2×2.8×10⁻³⁴ mol⁴·L⁻⁴ = 5.6×10⁻³⁵ < Kₛₚ[Al(OH)₃],所以没有生成Al(OH)₃沉淀。
答案:
(1)①Cu(OH)₂ ②B
(2)①3.57×10⁻⁴ ②2.8×10⁻¹² mol·L⁻¹
(3)不含有
(1)①因为Kₛₚ[Mg(OH)₂] > Kₛₚ[Cu(OH)₂],生成Cu(OH)₂所需要的c(OH⁻)小于生成Mg(OH)₂所需要的c(OH⁻),因此先生成Cu(OH)₂沉淀。②若要使Mg²⁺、Al³⁺同时生成沉淀,则应先加入氨水。
(2)①K = $\frac{c^{3}(H^{+})}{c(Fe^{3+})}$ = $\frac{c^{3}(H^{+})·c^{3}(OH^{-})}{c(Fe^{3+})·c^{3}(OH^{-})}$ = $\frac{K_{w}^{3}}{K_{sp}[Fe(OH)_{3}]}$ = $\frac{(1.0×10^{-14})^{3}}{2.8×10^{-39}}$ ≈ 3.57×10⁻⁴。②pH = 5时,c(Fe³⁺) = $\frac{2.8×10^{-39}}{(10^{-9})^{3}}$ mol·L⁻¹ = 2.8×10⁻¹² mol·L⁻¹。
(3)Fe³⁺恰好完全沉淀时,c³(OH⁻) = $\frac{2.8×10^{-39}}{1.0×10^{-5}}$ mol³·L⁻³ = 2.8×10⁻³⁴ mol³·L⁻³,c(Al³⁺)·c³(OH⁻) = 0.2×2.8×10⁻³⁴ mol⁴·L⁻⁴ = 5.6×10⁻³⁵ < Kₛₚ[Al(OH)₃],所以没有生成Al(OH)₃沉淀。
答案:
(1)①Cu(OH)₂ ②B
(2)①3.57×10⁻⁴ ②2.8×10⁻¹² mol·L⁻¹
(3)不含有
17.从铝土矿(主要成分是Al₂O₃,含SiO₂、Fe₂O₃、MgO等杂质)中提取氧化铝的两种工艺流程如下:
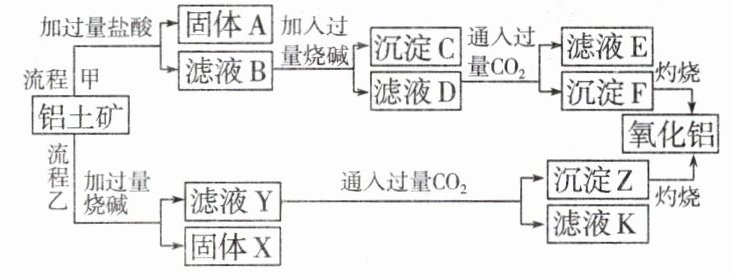
请回答下列问题:
(1)流程甲加入盐酸后生成Al³⁺的化学方程式为____________________。
(2)流程乙加入烧碱后生成SiO₃²⁻的离子方程式为____________________。
(3)验证滤液B中含Fe³⁺,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶液的一种用途____________________。
(5)已知298 K时,Mg(OH)₂的溶度积常数Kₛₚ=5.6×10⁻¹²,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg²⁺)是________。

请回答下列问题:
(1)流程甲加入盐酸后生成Al³⁺的化学方程式为____________________。
(2)流程乙加入烧碱后生成SiO₃²⁻的离子方程式为____________________。
(3)验证滤液B中含Fe³⁺,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶液的一种用途____________________。
(5)已知298 K时,Mg(OH)₂的溶度积常数Kₛₚ=5.6×10⁻¹²,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg²⁺)是________。
答案:
解析:
(1)Al₂O₃溶于盐酸生成AlCl₃和水,化学方程式为Al₂O₃ + 6HCl == 2AlCl₃ + 3H₂O。
(2)SiO₂与NaOH溶液反应的离子方程式为SiO₂ + 2OH⁻ == SiO₃²⁻ + H₂O。
(3)Fe³⁺的鉴定有多种方法,KSCN溶液、苯酚溶液、NaOH溶液等都可与之产生明显现象,若使用NaOH溶液,则NaOH溶液要过量。
(4)由于通入的是过量CO₂,因此滤液E和K中的主要成分是NaHCO₃,其用途广泛,工业上可用于制纯碱,也可用作食品添加剂。
(5)298 K,Mg(OH)₂的溶度积常数Kₛₚ = 5.6×10⁻¹²,即溶液中c(Mg²⁺)·c²(OH⁻) = 5.6×10⁻¹²。pH = 13的溶液中,c(OH⁻) = 0.1 mol·L⁻¹,则此时c(Mg²⁺) = $\frac{5.6×10^{-12}}{(0.1)^{2}}$ mol·L⁻¹ = 5.6×10⁻¹⁰ mol·L⁻¹。
答案:
(1)Al₂O₃ + 6HCl == 2AlCl₃ + 3H₂O
(2)SiO₂ + 2OH⁻ == SiO₃²⁻ + H₂O
(3)硫氰化钾(或苯酚溶液等合理答案均可)
(4)NaHCO₃ 制纯碱(或作发酵粉等合理答案均可)
(5)5.6×10⁻¹⁰ mol·L⁻¹
(1)Al₂O₃溶于盐酸生成AlCl₃和水,化学方程式为Al₂O₃ + 6HCl == 2AlCl₃ + 3H₂O。
(2)SiO₂与NaOH溶液反应的离子方程式为SiO₂ + 2OH⁻ == SiO₃²⁻ + H₂O。
(3)Fe³⁺的鉴定有多种方法,KSCN溶液、苯酚溶液、NaOH溶液等都可与之产生明显现象,若使用NaOH溶液,则NaOH溶液要过量。
(4)由于通入的是过量CO₂,因此滤液E和K中的主要成分是NaHCO₃,其用途广泛,工业上可用于制纯碱,也可用作食品添加剂。
(5)298 K,Mg(OH)₂的溶度积常数Kₛₚ = 5.6×10⁻¹²,即溶液中c(Mg²⁺)·c²(OH⁻) = 5.6×10⁻¹²。pH = 13的溶液中,c(OH⁻) = 0.1 mol·L⁻¹,则此时c(Mg²⁺) = $\frac{5.6×10^{-12}}{(0.1)^{2}}$ mol·L⁻¹ = 5.6×10⁻¹⁰ mol·L⁻¹。
答案:
(1)Al₂O₃ + 6HCl == 2AlCl₃ + 3H₂O
(2)SiO₂ + 2OH⁻ == SiO₃²⁻ + H₂O
(3)硫氰化钾(或苯酚溶液等合理答案均可)
(4)NaHCO₃ 制纯碱(或作发酵粉等合理答案均可)
(5)5.6×10⁻¹⁰ mol·L⁻¹
查看更多完整答案,请扫码查看


