2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1.已知$H_{2}(g)+F_{2}(g)=2HF(g)$ $\Delta H=-270kJ/mol$,下列说法正确的是 ( )
A.2 L 氟化氢气体分解成 1 L 氢气与 1 L 氟气吸收 270 kJ 热量
B.1 mol 氢气与 1 mol 氟气反应生成 2 mol 液态氟化氢放出的热量小于 270 kJ
C.在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于 2 mol 氟化氢气体的能量
D.1 个氢气分子与 1 个氟气分子反应生成 2 个氟化氢气体分子放出 270 kJ 热量
A.2 L 氟化氢气体分解成 1 L 氢气与 1 L 氟气吸收 270 kJ 热量
B.1 mol 氢气与 1 mol 氟气反应生成 2 mol 液态氟化氢放出的热量小于 270 kJ
C.在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于 2 mol 氟化氢气体的能量
D.1 个氢气分子与 1 个氟气分子反应生成 2 个氟化氢气体分子放出 270 kJ 热量
答案:
C 在热化学方程式中,ΔH的值与具体化学反应相对应,各物质前的计量数不再表示粒子数目,只表示物质的物质的量,故A、D错误;HF(g)→HF(l)会放出热量,故B项中放出热量应大于270 kJ,故B错误;该反应是放热反应,故C正确。
2.下列热化学方程式正确的是($\Delta H$的绝对值均正确) ( )
A.$C_{2}H_{5}OH(l)+3O_{2}(g)=2CO_{2}(g)+3H_{2}O(g)$ $\Delta H=-1367.0kJ/mol$(燃烧热)
B.$NaOH(aq)+HCl(aq)=NaCl(aq)+H_{2}O(l)$ $\Delta H=+57.3kJ/mol$(中和热)
C.$S(s)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-269.8kJ/mol$(反应热)
D.$2H_{2}(g)+O_{2}(g)=2H_{2}O(l)$ $\Delta H=+571.6kJ/mol$(反应热)
A.$C_{2}H_{5}OH(l)+3O_{2}(g)=2CO_{2}(g)+3H_{2}O(g)$ $\Delta H=-1367.0kJ/mol$(燃烧热)
B.$NaOH(aq)+HCl(aq)=NaCl(aq)+H_{2}O(l)$ $\Delta H=+57.3kJ/mol$(中和热)
C.$S(s)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-269.8kJ/mol$(反应热)
D.$2H_{2}(g)+O_{2}(g)=2H_{2}O(l)$ $\Delta H=+571.6kJ/mol$(反应热)
答案:
C 燃烧热要求可燃物的物质的量必须为1 mol,得到的氧化物必须是稳定的氧化物,H₂O的状态必须为液态,故A错误;中和反应是放热反应,ΔH应小于0,故B错误;热化学方程式的书写注明了物质的聚集状态、ΔH的正负数、数值、单位,故C正确;氢气与氧气反应放出热量,ΔH应小于0,故D错误。
3.下列有关热化学方程式及其叙述正确的是 ( )
A.氢气的燃烧热为 285.5 kJ·mol⁻¹,则水电解的热化学方程式为$2H_{2}O(l)=2H_{2}(g)+O_{2}(g)$ $\Delta H=+285.5kJ/mol$
B.1 mol 甲烷完全燃烧生成$CO_{2}$和$H_{2}O(l)$时放出 890 kJ 热量,它的热化学方程式为$\frac{1}{2}CH_{4}(g)+O_{2}(g)=\frac{1}{2}CO_{2}(g)+H_{2}O(l)$ $\Delta H=-445kJ/mol$
C.已知$2C(s)+O_{2}(g)=2CO(g)$ $\Delta H=-221kJ\cdot mol^{-1}$则 C(s)的燃烧热为 110.5 kJ·mol⁻¹
D.HF 与 NaOH 溶液反应:$H^{+}(aq)+OH^{-}(aq)=H_{2}O(l)$ $\Delta H=-57.3kJ/mol$
A.氢气的燃烧热为 285.5 kJ·mol⁻¹,则水电解的热化学方程式为$2H_{2}O(l)=2H_{2}(g)+O_{2}(g)$ $\Delta H=+285.5kJ/mol$
B.1 mol 甲烷完全燃烧生成$CO_{2}$和$H_{2}O(l)$时放出 890 kJ 热量,它的热化学方程式为$\frac{1}{2}CH_{4}(g)+O_{2}(g)=\frac{1}{2}CO_{2}(g)+H_{2}O(l)$ $\Delta H=-445kJ/mol$
C.已知$2C(s)+O_{2}(g)=2CO(g)$ $\Delta H=-221kJ\cdot mol^{-1}$则 C(s)的燃烧热为 110.5 kJ·mol⁻¹
D.HF 与 NaOH 溶液反应:$H^{+}(aq)+OH^{-}(aq)=H_{2}O(l)$ $\Delta H=-57.3kJ/mol$
答案:
B 根据燃烧热的定义,水电解的热化学方程式为2H₂O(l)=2H₂(g)+O₂(g) ΔH = +571 kJ·mol⁻¹,故A错误;1 mol甲烷完全燃烧放出的热量为890 kJ,则0.5 mol CH₄完全燃烧放出的热量为890×0.5 kJ = 445 kJ,热化学方程式为$\frac{1}{2}$CH₄(g)+O₂(g)=$\frac{1}{2}$CO₂(g)+H₂O(l) ΔH = -445 kJ·mol⁻¹,故B正确;C燃烧生成的稳定氧化物为CO₂,故C错误;HF为弱酸,与NaOH反应生成1 mol H₂O,放出的热量小于57.3 kJ,且HF应写成化学式形式,故D错误。
4.根据热化学方程式:$S(s)+O_{2}(g)=SO_{2}(g)$ $\Delta H=a kJ\cdot mol^{-1}(a = -297.2)$。分析下列说法,其中不正确的是 ( )
A.S(s)在$O_{2}(g)$中燃烧的反应是放热反应
B.$S(g)+O_{2}(g)=SO_{2}(g)$ $\Delta H = b kJ\cdot mol^{-1}$,则$a>b$
C.1 mol $SO_{2}(g)$所具有的能量低于 1 mol S(s)与 1 mol $O_{2}(g)$所具有的能量之和
D.16 g 固态硫在空气中充分燃烧,可吸收 148.6 kJ 的热量
A.S(s)在$O_{2}(g)$中燃烧的反应是放热反应
B.$S(g)+O_{2}(g)=SO_{2}(g)$ $\Delta H = b kJ\cdot mol^{-1}$,则$a>b$
C.1 mol $SO_{2}(g)$所具有的能量低于 1 mol S(s)与 1 mol $O_{2}(g)$所具有的能量之和
D.16 g 固态硫在空气中充分燃烧,可吸收 148.6 kJ 的热量
答案:
D 由题中条件可知:反应的热效应ΔH = a kJ·mol⁻¹ = -297.2 kJ·mol⁻¹,可知该反应的正反应为放热反应,故D错误。
5.已知化学反应:$C(s)+\frac{1}{2}O_{2}(g)=CO(g)$ $\Delta H_{1}<0$;$CO(g)+\frac{1}{2}O_{2}(g)=CO_{2}(g)$ $\Delta H_{2}<0$;$C(s)+O_{2}(g)=CO_{2}(g)$ $\Delta H_{3}<0$。下列说法正确的是(相同条件下) ( )
A.56 g CO 和 32 g $O_{2}$的总能量小于 88 g $CO_{2}$的能量
B.碳的燃烧热是$\Delta H_{3}$
C.$\Delta H_{1}<\Delta H_{3}$
D.28 g CO 的能量比 44 g $CO_{2}$的能量高
A.56 g CO 和 32 g $O_{2}$的总能量小于 88 g $CO_{2}$的能量
B.碳的燃烧热是$\Delta H_{3}$
C.$\Delta H_{1}<\Delta H_{3}$
D.28 g CO 的能量比 44 g $CO_{2}$的能量高
答案:
B CO燃烧是放热反应,反应物的总能量大于生成物的总能量,A错误;D中忽略了O₂的能量,错误;比较ΔH时必须带符号,C错误。
6.已知:$2CO(g)+O_{2}(g)=2CO_{2}(g)$ $\Delta H=-566kJ\cdot mol^{-1}$。下列说法正确的是 ( )
A.CO 的燃烧热为 283 kJ
B.CO 的燃烧热为 566 kJ·mol⁻¹
C.CO 的燃烧热$\Delta H=-283kJ$
D.下图可表示由 CO 生成$CO_{2}$的反应过程和能量关系
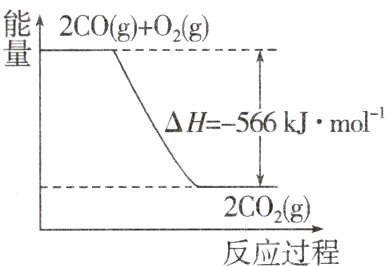
A.CO 的燃烧热为 283 kJ
B.CO 的燃烧热为 566 kJ·mol⁻¹
C.CO 的燃烧热$\Delta H=-283kJ$
D.下图可表示由 CO 生成$CO_{2}$的反应过程和能量关系

答案:
D A项,燃烧热的单位为kJ·mol⁻¹;B项,CO的燃烧热为283 kJ·mol⁻¹;C项,ΔH的单位为kJ·mol⁻¹。
7.根据能量变化示意图,下列说法正确的是 ( )
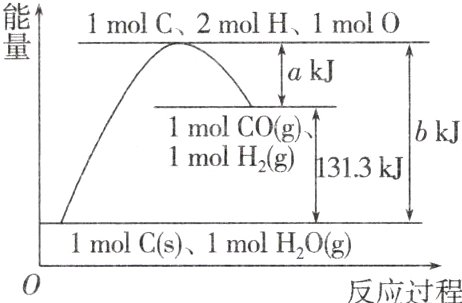
A.反应物的总能量高于生成物的总能量
B.2 mol H 和 1 mol O 结合生成 1 mol $H_{2}O$放出热量
C.1 mol C 和 1 mol $H_{2}O(g)$反应生成 1 mol CO 和 1 mol $H_{2}$,需要吸收 131.3 kJ 的热量
D.反应的热化学方程式可表示为$C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H=+(a - b)kJ\cdot mol^{-1}$

A.反应物的总能量高于生成物的总能量
B.2 mol H 和 1 mol O 结合生成 1 mol $H_{2}O$放出热量
C.1 mol C 和 1 mol $H_{2}O(g)$反应生成 1 mol CO 和 1 mol $H_{2}$,需要吸收 131.3 kJ 的热量
D.反应的热化学方程式可表示为$C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H=+(a - b)kJ\cdot mol^{-1}$
答案:
B 由图可知,反应物总能量小于生成物总能量,为吸热反应,A错误;原子形成化学键要放热,所以2 mol H和1 mol O结合生成1 mol H₂O放出热量,B正确;1 mol C和1 mol H₂O(g)反应生成1 mol CO和1 mol H₂吸收131.3 kJ的热量,物质的聚集状态不明确,C错误;由状态及焓变可知,热化学方程式可表示为C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +(b - a)kJ·mol⁻¹,D错误。
8.运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生 2 mol $NH_{3}$,放出 92.2 kJ 热量。
(1)合成氨反应的热化学方程式为____________________。
(2)若起始时向容器内充入 2 mol $N_{2}$和 6 mol $H_{2}$,达平衡后放出的热量为 Q,则 Q________(填“>”“<”或“=”)184.4 kJ。
(3)已知:
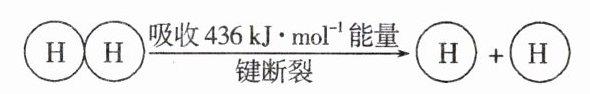
1 mol N—H 键断裂吸收的能量等于________kJ。
(1)合成氨反应的热化学方程式为____________________。
(2)若起始时向容器内充入 2 mol $N_{2}$和 6 mol $H_{2}$,达平衡后放出的热量为 Q,则 Q________(填“>”“<”或“=”)184.4 kJ。
(3)已知:

1 mol N—H 键断裂吸收的能量等于________kJ。
答案:
(1)根据题意直接写出合成氨反应的热化学方程式:N₂(g)+3H₂(g)⇌2NH₃(g) ΔH = -92.2 kJ·mol⁻¹。
(2)因合成氨反应是可逆反应,6 mol H₂不可能完全转化生成4 mol NH₃,故放出的热量小于184.4 kJ。
(3)设形成1 mol N - H键放出的能量为E,根据题中信息可知,断裂化学键吸收的总能量为945.8 kJ + 3×436 kJ = 2253.8 kJ,则有6×E - 2253.8 kJ = 92.2 kJ,所以E = 391 kJ,故1 mol N - H键断裂吸收的能量为391 kJ。
答案:
(1)N₂(g)+3H₂(g)=2NH₃(g) ΔH₁ = -92.2 kJ·mol⁻¹
(2)<
(3)391
(1)根据题意直接写出合成氨反应的热化学方程式:N₂(g)+3H₂(g)⇌2NH₃(g) ΔH = -92.2 kJ·mol⁻¹。
(2)因合成氨反应是可逆反应,6 mol H₂不可能完全转化生成4 mol NH₃,故放出的热量小于184.4 kJ。
(3)设形成1 mol N - H键放出的能量为E,根据题中信息可知,断裂化学键吸收的总能量为945.8 kJ + 3×436 kJ = 2253.8 kJ,则有6×E - 2253.8 kJ = 92.2 kJ,所以E = 391 kJ,故1 mol N - H键断裂吸收的能量为391 kJ。
答案:
(1)N₂(g)+3H₂(g)=2NH₃(g) ΔH₁ = -92.2 kJ·mol⁻¹
(2)<
(3)391
查看更多完整答案,请扫码查看


