2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
10. 如图是H₂与Cl₂发生反应生成HCl的途径和三个状态的能量,有关说法错误的是 ( )
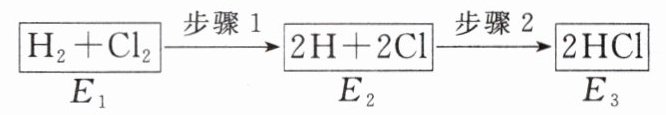
A. 步骤2是放热过程
B. 三个状态的能量中E₂最大
C. 要实现步骤1的转化,必须加热
D. 该反应的ΔH<0
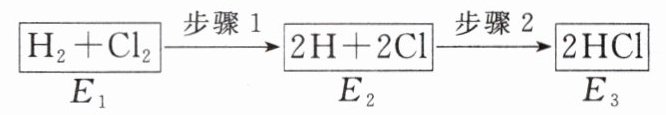
A. 步骤2是放热过程
B. 三个状态的能量中E₂最大
C. 要实现步骤1的转化,必须加热
D. 该反应的ΔH<0
答案:
C 步骤1为旧化学键断裂的过程,该过程吸收能量,步骤2为新化学键的形成过程,该过程放出能量,故三个状态的能量$E_{2}$最大;该反应可通过燃烧实现,为放热反应,$\Delta H\lt0$;要实现步骤1的转化可以通过点燃或光照等条件,故只有C项错误。
11. 根据如图所示的反应判断下列说法中错误的是 ( )
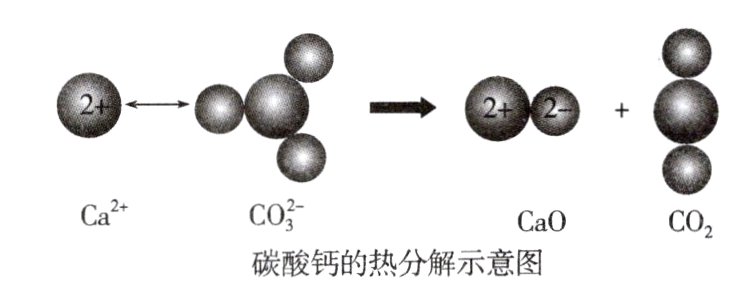
A. CO₂(g)和CaO(s)的总能量大于CaCO₃(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应

A. CO₂(g)和CaO(s)的总能量大于CaCO₃(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
答案:
D 反应吸热,生成物总能量高于反应物,A正确;反应吸热,焓变大于零,B正确;碳酸钙中既有离子键又有共价键,其分解时既有离子键断裂又有共价键断裂,C正确;燃烧需要加热,但都是放热反应,D错误。
12. 根据下图所示的N₂(g)和O₂(g)反应生成NO(g)过程中的能量变化情况,判断下列说法错误的是 ( )
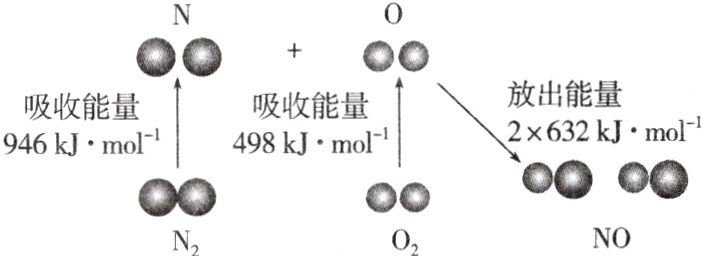
A. 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B. 2 mol气态氧原子结合生成O₂(g)时,能放出498 kJ能量
C. 断裂1 mol NO分子中的化学键,需要吸收632 kJ能量
D. 1 mol N₂(g)和1 mol O₂(g)生成2 mol NO(g)的反应热ΔH=-180 kJ·mol⁻¹

A. 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B. 2 mol气态氧原子结合生成O₂(g)时,能放出498 kJ能量
C. 断裂1 mol NO分子中的化学键,需要吸收632 kJ能量
D. 1 mol N₂(g)和1 mol O₂(g)生成2 mol NO(g)的反应热ΔH=-180 kJ·mol⁻¹
答案:
D 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量,A项正确;互逆过程的热量变化,$\Delta H$数值相等,符号相反,故B、C正确;$\Delta H=(946 + 498-2\times632)\ kJ\cdot mol^{-1}=+180\ kJ\cdot mol^{-1}$,D项错误。
13. 肼(H₂NNH₂)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H所需的能量(kJ)是 ( )
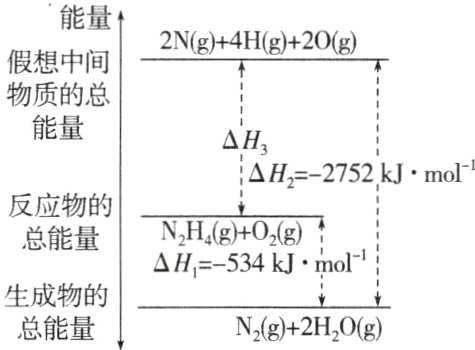
A. 194 B. 391 C. 516 D. 658

A. 194 B. 391 C. 516 D. 658
答案:
B 由图知$N_{2}H_{4}(g)+O_{2}(g)=N_{2}(g)+2H_{2}O(g)$ $\Delta H=-534\ kJ\cdot mol^{-1}$,可设断裂1 mol $N—H$所需的能量为$x$,$154\ kJ\cdot mol^{-1}+4x + 500\ kJ-2752\ kJ=-534\ kJ$,可求得$x = 391\ kJ$。
14. 某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定实验。
回答下列问题。
(1)倒入NaOH溶液的正确操作是________(填字母)。
A. 沿玻璃棒缓慢倒入
B. 一次迅速倒入
C. 分三次少量倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________(填字母)。
A. 用温度计小心搅拌
B. 揭开硬纸板用玻璃棒搅拌
C. 轻轻地振荡烧杯
D. 用玻璃搅拌器轻轻地搅拌
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
请填写下表中的空白:近似认为0.50 mol/L氢氧化钠溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm³,中和后生成溶液的比热容c=4.18 J/(g·℃)。

(4)计算中和热ΔH=________(保留至小数点后一位)。
(5)不能用Ba(OH)₂和硫酸代替盐酸和氢氧化钠溶液,理由是____________________。
回答下列问题。
(1)倒入NaOH溶液的正确操作是________(填字母)。
A. 沿玻璃棒缓慢倒入
B. 一次迅速倒入
C. 分三次少量倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________(填字母)。
A. 用温度计小心搅拌
B. 揭开硬纸板用玻璃棒搅拌
C. 轻轻地振荡烧杯
D. 用玻璃搅拌器轻轻地搅拌
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
请填写下表中的空白:近似认为0.50 mol/L氢氧化钠溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm³,中和后生成溶液的比热容c=4.18 J/(g·℃)。

(4)计算中和热ΔH=________(保留至小数点后一位)。
(5)不能用Ba(OH)₂和硫酸代替盐酸和氢氧化钠溶液,理由是____________________。
答案:
解析:
(1)用0.50 mol/L氢氧化钠溶液和0.50 mol/L硫酸溶液进行中和热的测定,倒入$NaOH$溶液的正确操作是一次迅速倒入。
(2)用玻璃搅拌器轻轻地搅拌使硫酸与$NaOH$溶液混合均匀。
(3)4次温度差分别为$4.0^{\circ}C$,$6.1^{\circ}C$,$3.9^{\circ}C$,$4.1^{\circ}C$,第2次数据相差较大,舍去,其他三次温度差平均值为$4.0^{\circ}C$。
(4)50 mL 0.50 mol/L氢氧化钠溶液与50 mL 0.50 mol/L硫酸溶液进行中和反应,生成水的物质的量为$0.05\ L\times0.50\ mol/L = 0.025\ mol$,溶液的质量为$80\ mL\times1\ g\cdot cm^{-3}=80\ g$,温度变化的值$\Delta t = 4.0^{\circ}C$,则生成0.025 mol水放出的热量$Q = m\cdot c\cdot\Delta t = 80\ g\times4.18\ J/(g\cdot^{\circ}C)\times4.0^{\circ}C = 1337.6\ J$,即1.3376 kJ,所以实验测得的中和热$\Delta H=-\frac{1.3376\ kJ}{0.025\ mol}\approx - 53.5\ kJ/mol$。
(5)硫酸与$Ba(OH)_{2}$溶液反应除了生成水外,还生成了$BaSO_{4}$沉淀,该反应中的沉淀生成热会影响反应的反应热,所以不能用硫酸和$Ba(OH)_{2}$代替盐酸和氢氧化钠溶液。
答案:
(1)B
(2)D
(3)4.0
(4)$-53.5\ kJ/mol$
(5)$Ba(OH)_{2}$和硫酸反应除生成水外,还有硫酸钡生成,会影响反应热的测定
(1)用0.50 mol/L氢氧化钠溶液和0.50 mol/L硫酸溶液进行中和热的测定,倒入$NaOH$溶液的正确操作是一次迅速倒入。
(2)用玻璃搅拌器轻轻地搅拌使硫酸与$NaOH$溶液混合均匀。
(3)4次温度差分别为$4.0^{\circ}C$,$6.1^{\circ}C$,$3.9^{\circ}C$,$4.1^{\circ}C$,第2次数据相差较大,舍去,其他三次温度差平均值为$4.0^{\circ}C$。
(4)50 mL 0.50 mol/L氢氧化钠溶液与50 mL 0.50 mol/L硫酸溶液进行中和反应,生成水的物质的量为$0.05\ L\times0.50\ mol/L = 0.025\ mol$,溶液的质量为$80\ mL\times1\ g\cdot cm^{-3}=80\ g$,温度变化的值$\Delta t = 4.0^{\circ}C$,则生成0.025 mol水放出的热量$Q = m\cdot c\cdot\Delta t = 80\ g\times4.18\ J/(g\cdot^{\circ}C)\times4.0^{\circ}C = 1337.6\ J$,即1.3376 kJ,所以实验测得的中和热$\Delta H=-\frac{1.3376\ kJ}{0.025\ mol}\approx - 53.5\ kJ/mol$。
(5)硫酸与$Ba(OH)_{2}$溶液反应除了生成水外,还生成了$BaSO_{4}$沉淀,该反应中的沉淀生成热会影响反应的反应热,所以不能用硫酸和$Ba(OH)_{2}$代替盐酸和氢氧化钠溶液。
答案:
(1)B
(2)D
(3)4.0
(4)$-53.5\ kJ/mol$
(5)$Ba(OH)_{2}$和硫酸反应除生成水外,还有硫酸钡生成,会影响反应热的测定
查看更多完整答案,请扫码查看


