2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 锅炉水垢是一种安全隐患,除去水垢中的CaSO₄,可先用Na₂CO₃溶液处理,使之转化为易溶于酸的CaCO₃,而后用酸除去。下列说法不正确的是( )
A. CaCO₃的溶解度小于CaSO₄
B. 沉淀转化的实质是沉淀溶解平衡的移动
C. 沉淀转化的难易与溶解度差别的大小无关
D. CaSO₄到CaCO₃的沉淀转化中并存着两个沉淀溶解平衡
A. CaCO₃的溶解度小于CaSO₄
B. 沉淀转化的实质是沉淀溶解平衡的移动
C. 沉淀转化的难易与溶解度差别的大小无关
D. CaSO₄到CaCO₃的沉淀转化中并存着两个沉淀溶解平衡
答案:
C 沉淀转化的方向是难溶物向更难溶的方向转化,所以沉淀的溶解度差别越大,越易转化,C选项错误。
2. 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO₄溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO₄与ZnS反应的离子方程式是Cu²⁺ + S²⁻ = CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO₄与ZnS反应的离子方程式是Cu²⁺ + S²⁻ = CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
答案:
D CuSO₄与PbS反应可以生成CuS,所以CuS的溶解度小于PbS的,A错误;硫化物中硫的化合价为 -2,均具有还原性,B错误;ZnS难溶于水,不能写成离子形式,C错误;铜的硫化物首先被氧化成CuSO₄,然后硫酸铜与ZnS、PbS发生复分解反应生成更难溶的CuS,D正确。
3. 下列化学原理的应用,主要是利用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[BaCl₂、Ba(NO₃)₂]当作食盐食用后,常用0.5%的Na₂SO₄溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
A. ②③④ B. ①②③
C. ③④⑤ D. ①②③④⑤
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[BaCl₂、Ba(NO₃)₂]当作食盐食用后,常用0.5%的Na₂SO₄溶液解毒
③溶洞、珊瑚的形成
④碳酸钡不能作“钡餐”而硫酸钡则能
⑤泡沫灭火器灭火的原理
A. ②③④ B. ①②③
C. ③④⑤ D. ①②③④⑤
答案:
A
4. 实验:①0.1 mol·L⁻¹ AgNO₃溶液和0.1 mol·L⁻¹ NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L⁻¹ KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L⁻¹ KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
B. 滤液b中不含有Ag⁺
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
②向滤液b中滴加0.1 mol·L⁻¹ KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L⁻¹ KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
B. 滤液b中不含有Ag⁺
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
答案:
B A项,在浊液a中,存在AgCl的沉淀溶解平衡,正确;B项,在滤液b中,仍含有少量Ag⁺,故在b中加入KI溶液生成了AgI沉淀,错误;由于AgI比AgCl更难溶解,向c中加入0.1 mol·L⁻¹ KI溶液,能发生沉淀的转化,生成黄色的AgI,C项和D项都正确。
5. 已知常温下Kₛₚ(AgCl) = 1.8×10⁻¹⁰,Kₛₚ(AgBr) = 5×10⁻¹³,下列有关说法错误的是( )
A. 在饱和AgCl、AgBr的混合溶液中:$\frac{c(Cl^{-})}{c(Br^{-})}$ = 360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Kₛₚ均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L⁻¹
A. 在饱和AgCl、AgBr的混合溶液中:$\frac{c(Cl^{-})}{c(Br^{-})}$ = 360
B. 向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C. AgCl在水中溶解度及Kₛₚ均比在NaCl溶液中的大
D. 欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol·L⁻¹
答案:
C A项,同一溶液中,c(Ag⁺)相同,溶液中同时存在如下两种关系式c(Ag⁺)·c(Br⁻)=Kₛₚ(AgBr),c(Ag⁺)·c(Cl⁻)=Kₛₚ(AgCl),所以$\frac{c(Cl⁻)}{c(Br⁻)}=\frac{Kₛₚ(AgCl)}{Kₛₚ(AgBr)} = 360$,正确;B项,由于Kₛₚ(AgCl)>Kₛₚ(AgBr),氯化银容易转化为溴化银浅黄色沉淀,正确;C项,溶度积只与温度有关,错误;D项,AgBr + Cl⁻⇌AgCl + Br⁻,K=$\frac{c(Br⁻)}{c(Cl⁻)}=\frac{Kₛₚ(AgBr)}{Kₛₚ(AgCl)}$,当溴化银全部转化为氯化银时,溶液中溴离子浓度为0.01 mol·L⁻¹,将有关数据代入计算式,求得平衡时c(Cl⁻)=3.6 mol·L⁻¹,溴化银转化过程中消耗了0.01 mol·L⁻¹氯化钠,故氯化钠的最低浓度为3.61 mol·L⁻¹,D正确。
6. 已知Kₛₚ(AgCl) = 1.8×10⁻¹⁰,Kₛₚ(AgI) = 1.0×10⁻¹⁶。下列说法错误的是( )
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001 mol·L⁻¹的Cl⁻、I⁻的溶液中缓慢加入AgNO₃稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10⁻¹¹ mol·L⁻¹
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001 mol·L⁻¹的Cl⁻、I⁻的溶液中缓慢加入AgNO₃稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10⁻¹¹ mol·L⁻¹
答案:
A 组成结构相似的物质,溶度积越小,其溶解度越小,越易先形成沉淀,B项正确;溶解度小的沉淀转化成溶解度更小的沉淀容易实现,所以A项错误、C项正确;AgCl溶液中c(Ag⁺)=$\sqrt{1.8×10⁻⁵}$ mol·L⁻¹。要使AgI形成沉淀,则c(Ag⁺)·c(I⁻)≥1.0×10⁻¹⁶。则c(I⁻)≥$\frac{1.0×10⁻¹⁶}{\sqrt{1.8×10⁻⁵}}$ mol·L⁻¹=$\frac{1}{\sqrt{1.8}}×10⁻¹¹$ mol·L⁻¹,D正确。
7. 下列说法正确的是( )
A. 常温下,向饱和Na₂CO₃溶液中加入少量BaSO₄粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Kₛₚ(BaCO₃)<Kₛₚ(BaSO₄)
B. 常温下,向纯水中加入钠或氢氧化钠都能使水的电离平衡逆向移动,水的离子积不变
C. 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性
D. 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡
A. 常温下,向饱和Na₂CO₃溶液中加入少量BaSO₄粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Kₛₚ(BaCO₃)<Kₛₚ(BaSO₄)
B. 常温下,向纯水中加入钠或氢氧化钠都能使水的电离平衡逆向移动,水的离子积不变
C. 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性
D. 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡
答案:
D A项不符合客观事实,Kₛₚ(BaCO₃)>Kₛₚ(BaSO₄);钠和水反应,放出大量的热,温度升高,水的离子积增大,B错误;将二氧化硫气体通入到酸性高锰酸钾溶液中,溶液褪色,体现了二氧化硫的还原性,故C错误;Na₂CO₃溶液存在水解平衡,加氯化钡与碳酸根离子反应,水解平衡逆向移动,则红色逐渐褪去,故D正确。
8. 在T℃时,铬酸银(Ag₂CrO₄)在水溶液中的沉淀溶解平衡曲线如图所示。
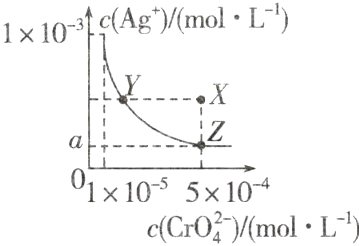
下列说法中不正确的是( )
A. T℃时,在Y点和Z点,Ag₂CrO₄的Kₛₚ相等
B. 向饱和Ag₂CrO₄溶液中加入固体K₂CrO₄不能使溶液由Y点变为X点
C. T℃时,Ag₂CrO₄的Kₛₚ为1×10⁻⁸
D. 图中a = $\sqrt{2}$×10⁻⁴
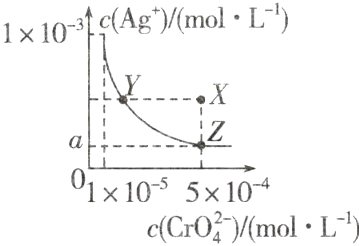
下列说法中不正确的是( )
A. T℃时,在Y点和Z点,Ag₂CrO₄的Kₛₚ相等
B. 向饱和Ag₂CrO₄溶液中加入固体K₂CrO₄不能使溶液由Y点变为X点
C. T℃时,Ag₂CrO₄的Kₛₚ为1×10⁻⁸
D. 图中a = $\sqrt{2}$×10⁻⁴
答案:
C 一定温度下溶度积是常数,所以T℃时,Y点和Z点Ag₂CrO₄的Kₛₚ相等,A正确;在饱和Ag₂CrO₄溶液中加入K₂CrO₄固体仍为饱和溶液,点仍在曲线上,所以不能使溶液由Y点变为X点,B正确;曲线上的点都是沉淀溶解平衡点,Ag₂CrO₄的沉淀溶解平衡为Ag₂CrO₄(s)⇌2Ag⁺(aq)+CrO₄²⁻(aq),Kₛₚ = c²(Ag⁺)·c(CrO₄²⁻)=(1×10⁻³)²×1×10⁻⁵ = 10⁻¹¹,C错误;Kₛₚ(Ag₂CrO₄)=c²(Ag⁺)·c(CrO₄²⁻)=1×10⁻¹¹,Z点时c(CrO₄²⁻)=5×10⁻⁴,c²(Ag⁺)=2×10⁻⁸,所以a=$\sqrt{2}×10⁻⁴$,D正确。
9. 已知:25℃时,Kₛₚ(BaSO₄) = 1×10⁻¹⁰,Kₛₚ(BaCO₃) = 1×10⁻⁹。
(1)医学上进行消化系统的X射线透视时,常使用BaSO₄作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO₄仍然是安全的,BaSO₄不溶于酸的原因是(用溶解平衡原理解释)______________________。万一误服了少量BaCO₃,应尽快用大量0.5 mol·L⁻¹ Na₂SO₄溶液洗胃,如果忽略洗胃过程中Na₂SO₄溶液浓度的变化,残留在胃液中的Ba²⁺浓度仅为__________mol·L⁻¹。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO₄,可先用Na₂CO₃溶液处理,使之转化为疏松、易溶于酸的CaCO₃,而后用酸除去。
①CaSO₄转化为CaCO₃的离子方程式为______________________。
②请分析CaSO₄转化为CaCO₃的原理:______________________________。
(1)医学上进行消化系统的X射线透视时,常使用BaSO₄作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO₄仍然是安全的,BaSO₄不溶于酸的原因是(用溶解平衡原理解释)______________________。万一误服了少量BaCO₃,应尽快用大量0.5 mol·L⁻¹ Na₂SO₄溶液洗胃,如果忽略洗胃过程中Na₂SO₄溶液浓度的变化,残留在胃液中的Ba²⁺浓度仅为__________mol·L⁻¹。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO₄,可先用Na₂CO₃溶液处理,使之转化为疏松、易溶于酸的CaCO₃,而后用酸除去。
①CaSO₄转化为CaCO₃的离子方程式为______________________。
②请分析CaSO₄转化为CaCO₃的原理:______________________________。
答案:
解析:BaSO₄(s)⇌Ba²⁺(aq)+SO₄²⁻(aq),由于Ba²⁺、SO₄²⁻均不与H⁺反应,无法使平衡移动。c(Ba²⁺)=$\frac{Kₛₚ(BaSO₄)}{c(SO₄²⁻)}=2×10⁻¹⁰$ mol·L⁻¹。
答案:
(1)对于平衡BaSO₄(s)⇌Ba²⁺(aq)+SO₄²⁻(aq),H⁺不能减少Ba²⁺或SO₄²⁻的浓度,平衡不能向沉淀溶解的方向移动 2×10⁻¹⁰
(2)①CaSO₄(s)+CO₃²⁻(aq)⇌CaCO₃(s)+SO₄²⁻(aq)
②CaSO₄存在沉淀溶解平衡,加入Na₂CO₃溶液后,CO₃²⁻与Ca²⁺结合生成CaCO₃沉淀,Ca²⁺浓度减小,使CaSO₄的沉淀溶解平衡向溶解方向移动
答案:
(1)对于平衡BaSO₄(s)⇌Ba²⁺(aq)+SO₄²⁻(aq),H⁺不能减少Ba²⁺或SO₄²⁻的浓度,平衡不能向沉淀溶解的方向移动 2×10⁻¹⁰
(2)①CaSO₄(s)+CO₃²⁻(aq)⇌CaCO₃(s)+SO₄²⁻(aq)
②CaSO₄存在沉淀溶解平衡,加入Na₂CO₃溶液后,CO₃²⁻与Ca²⁺结合生成CaCO₃沉淀,Ca²⁺浓度减小,使CaSO₄的沉淀溶解平衡向溶解方向移动
查看更多完整答案,请扫码查看


