2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
7.氯原子对O₃分解有催化作用:
O₃+Cl=ClO+O₂ ΔH₁
ClO+O=Cl+O₂ ΔH₂
大气臭氧层的分解反应是:O₃ + O = 2O₂ ΔH,该反应的能量变化如图:

下列叙述中,正确的是( )
A.反应O₃ + O = 2O₂的ΔH = E₁ - E₃
B.O₃ + O = 2O₂是吸热反应
C.ΔH = ΔH₁ + ΔH₂
D.ΔH = E₃ - E₂>0
O₃+Cl=ClO+O₂ ΔH₁
ClO+O=Cl+O₂ ΔH₂
大气臭氧层的分解反应是:O₃ + O = 2O₂ ΔH,该反应的能量变化如图:

下列叙述中,正确的是( )
A.反应O₃ + O = 2O₂的ΔH = E₁ - E₃
B.O₃ + O = 2O₂是吸热反应
C.ΔH = ΔH₁ + ΔH₂
D.ΔH = E₃ - E₂>0
答案:
C A项,$\Delta H =$生成物总能量 - 反应物总能量$=E_{3}-E_{2}$,故A错误;B项,由$E_{2}>E_{3}$知反应物总能量大于生成物总能量,故$O_{3}+O=2O_{2}$为放热反应,故B错误;C项,据盖斯定律将两式相加得$\Delta H=\Delta H_{1}+\Delta H_{2}$,故C正确;D项,由于$O_{3}+O=2O_{2}$放热,所以$\Delta H=E_{3}-E_{2}<0$,故D错误。
8.已知Ca(OH)₂固体溶于水放热,与Ca(OH)₂体系相关的能量关系如图所示,下列说法正确的是( )

A.ΔH₄<0
B.ΔH₁ + ΔH₂>0
C.ΔH₃>ΔH₂
D.ΔH₁ + ΔH₂ + ΔH₄ + ΔH₅ + ΔH₆ = 0

A.ΔH₄<0
B.ΔH₁ + ΔH₂>0
C.ΔH₃>ΔH₂
D.ΔH₁ + ΔH₂ + ΔH₄ + ΔH₅ + ΔH₆ = 0
答案:
C A.$Ca(OH)_{2}$固体电离产生离子吸热,则$\Delta H_{4}>0$,错误;B.$Ca(OH)_{2}$固体溶于水放热,则$\Delta H_{1}+\Delta H_{2}<0$,错误;C.断裂化学键吸收能量,焓变为正,而$CaO$与水反应放热,焓变为负,则$\Delta H_{3}>\Delta H_{2}$,正确;D.结合盖斯定律可知,$\Delta H_{1}+\Delta H_{2}-\Delta H_{5}-\Delta H_{6}=\Delta H_{4}$,则$\Delta H_{1}+\Delta H_{2}-\Delta H_{4}-\Delta H_{5}-\Delta H_{6}=0$,错误。
9.(1)如图是N₂(g)和H₂(g)反应生成1 mol NH₃(g)过程中能量变化示意图,请写出N₂(g)和H₂(g)反应的热化学方程式:________________________。

(2)若已知下列数据:

根据表中及图中数据计算N—H键的键能是______kJ·mol⁻¹。
(3)用NH₃催化还原NO,还可以消除氮氧化物的污染。已知:
4NH₃(g)+3O₂(g)=2N₂(g)+6H₂O(g) ΔH₁ = -a kJ·mol⁻¹ ①
N₂(g)+O₂(g)=2NO(g) ΔH₂ = -b kJ·mol⁻¹ ②
求:若1 mol NH₃还原NO至N₂,则该反应过程中的反应热ΔH₃ = ______kJ·mol⁻¹(用含a、b的式子表示)。

(2)若已知下列数据:

根据表中及图中数据计算N—H键的键能是______kJ·mol⁻¹。
(3)用NH₃催化还原NO,还可以消除氮氧化物的污染。已知:
4NH₃(g)+3O₂(g)=2N₂(g)+6H₂O(g) ΔH₁ = -a kJ·mol⁻¹ ①
N₂(g)+O₂(g)=2NO(g) ΔH₂ = -b kJ·mol⁻¹ ②
求:若1 mol NH₃还原NO至N₂,则该反应过程中的反应热ΔH₃ = ______kJ·mol⁻¹(用含a、b的式子表示)。
答案:
(1)$N_{2}(g)+3H_{2}(g)\rightleftharpoons2NH_{3}(g)$ $\Delta H=-92\ kJ\cdot mol^{-1}$
(2)$390$
(3)$(3b - a)/4$
(1)$N_{2}(g)+3H_{2}(g)\rightleftharpoons2NH_{3}(g)$ $\Delta H=-92\ kJ\cdot mol^{-1}$
(2)$390$
(3)$(3b - a)/4$
10.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
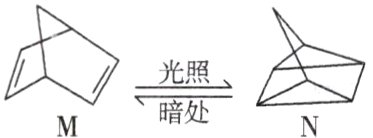
ΔH = +88.6 kJ·mol⁻¹,则M、N相比,较稳定的是______。(用“M”或“N”表示)
(2)已知CH₃OH(l)的燃烧热ΔH = -238.6 kJ·mol⁻¹,CH₃OH(l)+1/2O₂(g)=CO₂(g)+2H₂(g) ΔH = -a kJ·mol⁻¹,则a______238.6(填“>”“<”或“=”)。
(3)使Cl₂和H₂O(g)通过灼热的炭层,生成HCl和CO₂,当有1 mol Cl₂参与反应时释放出145 kJ热量,写出该反应的热化学方程式:________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO₂(s)+3C(s)=2Al₂O₃(s)+3TiC(s) ΔH = -1176 kJ·mol⁻¹,则反应过程中,每转移1 mol电子放出的热量为______kJ。
(5)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe₂O₃(s)+3CO(g)=2Fe(s)+3CO₂(g) ΔH = -24.8 kJ·mol⁻¹
②3Fe₂O₃(s)+CO(g)=2Fe₃O₄(s)+CO₂(g) ΔH = -47.2 kJ·mol⁻¹
③Fe₃O₄(s)+CO(g)=3FeO(s)+CO₂(g) ΔH = +640.5 kJ·mol⁻¹
写出CO气体还原FeO固体得到Fe固体和CO₂气体的热化学反应方程式:______________________________。
(1)有机物M经过太阳光光照可转化成N,转化过程如图:

ΔH = +88.6 kJ·mol⁻¹,则M、N相比,较稳定的是______。(用“M”或“N”表示)
(2)已知CH₃OH(l)的燃烧热ΔH = -238.6 kJ·mol⁻¹,CH₃OH(l)+1/2O₂(g)=CO₂(g)+2H₂(g) ΔH = -a kJ·mol⁻¹,则a______238.6(填“>”“<”或“=”)。
(3)使Cl₂和H₂O(g)通过灼热的炭层,生成HCl和CO₂,当有1 mol Cl₂参与反应时释放出145 kJ热量,写出该反应的热化学方程式:________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO₂(s)+3C(s)=2Al₂O₃(s)+3TiC(s) ΔH = -1176 kJ·mol⁻¹,则反应过程中,每转移1 mol电子放出的热量为______kJ。
(5)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe₂O₃(s)+3CO(g)=2Fe(s)+3CO₂(g) ΔH = -24.8 kJ·mol⁻¹
②3Fe₂O₃(s)+CO(g)=2Fe₃O₄(s)+CO₂(g) ΔH = -47.2 kJ·mol⁻¹
③Fe₃O₄(s)+CO(g)=3FeO(s)+CO₂(g) ΔH = +640.5 kJ·mol⁻¹
写出CO气体还原FeO固体得到Fe固体和CO₂气体的热化学反应方程式:______________________________。
答案:
(1)$M$
(2)$<$
(3)$2Cl_{2}(g)+2H_{2}O(g)+C(s)=4HCl(g)+CO_{2}(g)$ $\Delta H=-290\ kJ\cdot mol^{-1}$
(4)$98$
(5)$FeO(s)+CO(g)=Fe(s)+CO_{2}(g)$ $\Delta H=-218.0\ kJ\cdot mol^{-1}$
(1)$M$
(2)$<$
(3)$2Cl_{2}(g)+2H_{2}O(g)+C(s)=4HCl(g)+CO_{2}(g)$ $\Delta H=-290\ kJ\cdot mol^{-1}$
(4)$98$
(5)$FeO(s)+CO(g)=Fe(s)+CO_{2}(g)$ $\Delta H=-218.0\ kJ\cdot mol^{-1}$
查看更多完整答案,请扫码查看


