2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
10. 在湿法炼锌的电解循环溶液中,较高浓度的Cl⁻会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO₄,生成CuCl沉淀从而除去Cl⁻。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )

A. Kₛₚ(CuCl)的数量级为10⁻⁷
B. 除Cl⁻反应为Cu + Cu²⁺ + 2Cl⁻ = 2CuCl
C. 加入Cu越多,Cu⁺浓度越高,除Cl⁻效果越好
D. 2Cu⁺ = Cu²⁺ + Cu平衡常数很大,反应趋于完全

A. Kₛₚ(CuCl)的数量级为10⁻⁷
B. 除Cl⁻反应为Cu + Cu²⁺ + 2Cl⁻ = 2CuCl
C. 加入Cu越多,Cu⁺浓度越高,除Cl⁻效果越好
D. 2Cu⁺ = Cu²⁺ + Cu平衡常数很大,反应趋于完全
答案:
C 由题图可知,当 -lg$\frac{c(Cl⁻)}{mol·L⁻¹}=0$时,lg$\frac{c(Cu⁺)}{mol·L⁻¹}$约为 -7,即c(Cl⁻)=1 mol·L⁻¹,c(Cu⁺)=10⁻⁷ mol·L⁻¹,则Kₛₚ(CuCl)=c(Cu⁺)·c(Cl⁻)的数量级为10⁻⁷,A项正确;根据题目信息可知B项正确;Cu为固体,浓度视为常数,只要满足反应用量即可,过多的铜也不会影响平衡状态的移动,C项错误;由题图可知,交点处c(Cu⁺)=c(Cu²⁺)≈10⁻⁶ mol·L⁻¹,则2Cu⁺⇌Cu²⁺ + Cu的平衡常数K=$\frac{c(Cu²⁺)}{c²(Cu⁺)}≈10⁶$,该平衡常数很大,因而反应趋于完全,D项正确。
11. 25℃时,三种难溶银盐的Kₛₚ与颜色如表所示,
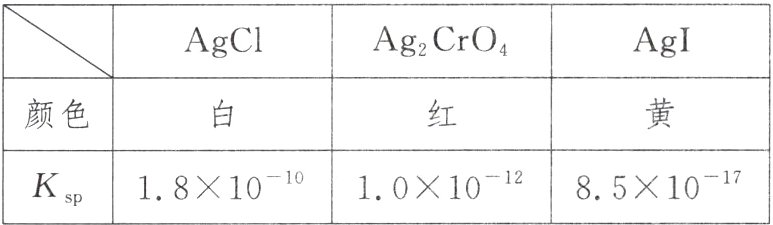
下列说法正确的是( )
A. Ag₂CrO₄和AgI饱和溶液中,c(Ag⁺)前者小于后者
B. 浓度均为2×10⁻⁵ mol·L⁻¹的NaCl和AgNO₃溶液等体积混合能产生白色沉淀
C. 向AgCl悬浊液中逐滴加入0.1 mol·L⁻¹ KI溶液,沉淀将由白色转化为黄色
D. 向浓度均为0.01 mol·L⁻¹的KCl与K₂CrO₄混合溶液中慢慢滴入AgNO₃溶液,先生成红色沉淀

下列说法正确的是( )
A. Ag₂CrO₄和AgI饱和溶液中,c(Ag⁺)前者小于后者
B. 浓度均为2×10⁻⁵ mol·L⁻¹的NaCl和AgNO₃溶液等体积混合能产生白色沉淀
C. 向AgCl悬浊液中逐滴加入0.1 mol·L⁻¹ KI溶液,沉淀将由白色转化为黄色
D. 向浓度均为0.01 mol·L⁻¹的KCl与K₂CrO₄混合溶液中慢慢滴入AgNO₃溶液,先生成红色沉淀
答案:
C 由表中数据可知,AgI饱和溶液中c(Ag⁺)=$\sqrt{8.5×10⁻¹⁷}=9.2×10⁻⁹$ mol·L⁻¹,Ag₂CrO₄饱和溶液中:c(Ag⁺)=$\sqrt[3]{2×2×10⁻¹²}=1.59×10⁻⁴$ mol·L⁻¹>9.2×10⁻⁹ mol·L⁻¹,即Ag₂CrO₄和AgI饱和溶液中,c(Ag⁺)前者大于后者,故A错误;浓度均为2×10⁻⁵ mol·L⁻¹的NaCl和AgNO₃溶液等体积混合时瞬间c(Ag⁺)=c(Cl⁻)=$\frac{1}{2}×2×10⁻⁵$ mol·L⁻¹=10⁻⁵ mol·L⁻¹,此时Q=10⁻⁵×10⁻⁵=10⁻¹⁰<1.8×10⁻¹⁰=Kₛₚ(AgCl),所以不能产生白色沉淀,故B错误;AgI溶度积小于AgCl,溶解度小的沉淀转化为溶解度更小的沉淀容易实现,所以向AgCl悬浊液加入KI溶液,沉淀将由白色转化为黄色AgI沉淀,故C正确;浓度均为0.01 mol·L⁻¹的KCl与K₂CrO₄混合溶液中慢慢滴入AgNO₃溶液,产生AgCl时最小的c(Ag⁺)=$\frac{Kₛₚ(AgCl)}{c(Cl⁻)}=\frac{1.8×10⁻¹⁰}{0.01}$ mol·L⁻¹=1.8×10⁻⁸ mol·L⁻¹,产生Ag₂CrO₄时最小的c(Ag⁺)=$\sqrt{\frac{Kₛₚ(Ag₂CrO₄)}{c(CrO₄²⁻)}}=\sqrt{\frac{2.0×10⁻¹²}{0.01}}$ mol·L⁻¹=1.41×10⁻⁵ mol·L⁻¹>1.8×10⁻⁸ mol·L⁻¹,所以随着AgNO₃溶液的慢慢滴入,先生成白色AgCl沉淀,故D错误。
12. 常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液的pH关系如图所示。

下列说法正确的是( )
A. a点代表Fe(OH)₂饱和溶液
B. Kₛₚ[Fe(OH)₃]<Kₛₚ[Al(OH)₃]<Kₛₚ[Fe(OH)₂]<Kₛₚ[Mg(OH)₂]
C. 向0.1 mol·L⁻¹ Al³⁺、Mg²⁺、Fe²⁺混合溶液中,逐滴滴加稀NaOH溶液,Mg²⁺最先沉淀
D. 在pH = 7的溶液中,Fe³⁺、Al³⁺、Fe²⁺能大量共存

下列说法正确的是( )
A. a点代表Fe(OH)₂饱和溶液
B. Kₛₚ[Fe(OH)₃]<Kₛₚ[Al(OH)₃]<Kₛₚ[Fe(OH)₂]<Kₛₚ[Mg(OH)₂]
C. 向0.1 mol·L⁻¹ Al³⁺、Mg²⁺、Fe²⁺混合溶液中,逐滴滴加稀NaOH溶液,Mg²⁺最先沉淀
D. 在pH = 7的溶液中,Fe³⁺、Al³⁺、Fe²⁺能大量共存
答案:
B
13. 工业制氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO + 2HCl = CuCl₂ + H₂O,FeO + 2HCl = FeCl₂ + H₂O。已知:pH≥9.6时,Fe²⁺以Fe(OH)₂的形式完全沉淀;pH≥6.4时,Cu²⁺以Cu(OH)₂的形式完全沉淀;pH为3~4时,Fe³⁺以Fe(OH)₃的形式完全沉淀。
(1)为除去溶液中的Fe²⁺,可采用的方法是( )
A. 直接加碱,调整溶液pH≥9.6
B. 加纯铜粉,将Fe²⁺还原出来
C. 先将Fe²⁺氧化成Fe³⁺,再调整pH到3~4
D. 通入硫化氢,使Fe²⁺直接沉淀
(2)工业上为除去溶液中的Fe²⁺,常使用NaClO,当溶液中加入NaClO后,溶液pH变化情况是( )
A. 肯定减小 B. 肯定增大
C. 可能减小 D. 可能增大
(3)若此溶液中只含有Fe³⁺时,要调整pH为3~4,此时最好向溶液中加入( )
A. NaOH溶液 B. 氨水
C. CuCl₂溶液 D. CuO固体
(1)为除去溶液中的Fe²⁺,可采用的方法是( )
A. 直接加碱,调整溶液pH≥9.6
B. 加纯铜粉,将Fe²⁺还原出来
C. 先将Fe²⁺氧化成Fe³⁺,再调整pH到3~4
D. 通入硫化氢,使Fe²⁺直接沉淀
(2)工业上为除去溶液中的Fe²⁺,常使用NaClO,当溶液中加入NaClO后,溶液pH变化情况是( )
A. 肯定减小 B. 肯定增大
C. 可能减小 D. 可能增大
(3)若此溶液中只含有Fe³⁺时,要调整pH为3~4,此时最好向溶液中加入( )
A. NaOH溶液 B. 氨水
C. CuCl₂溶液 D. CuO固体
答案:
解析:
(1)A项中pH≥9.6时,Cu²⁺也将沉淀;B项中,铜粉不能将Fe²⁺还原出来;D项中,Fe²⁺与H₂S不反应。
(2)NaClO具有强氧化性,能将Fe²⁺氧化:2Fe²⁺ + ClO⁻ + 2H⁺=2Fe³⁺ + Cl⁻ + H₂O,反应中消耗H⁺,pH一定增大。
(3)此溶液中只含杂质Fe³⁺,要调整pH到3~4,加入的物质必须能与酸反应,使c(H⁺)减小,且不引入新的杂质离子,D项符合条件。
答案:
(1)C
(2)B
(3)D
(1)A项中pH≥9.6时,Cu²⁺也将沉淀;B项中,铜粉不能将Fe²⁺还原出来;D项中,Fe²⁺与H₂S不反应。
(2)NaClO具有强氧化性,能将Fe²⁺氧化:2Fe²⁺ + ClO⁻ + 2H⁺=2Fe³⁺ + Cl⁻ + H₂O,反应中消耗H⁺,pH一定增大。
(3)此溶液中只含杂质Fe³⁺,要调整pH到3~4,加入的物质必须能与酸反应,使c(H⁺)减小,且不引入新的杂质离子,D项符合条件。
答案:
(1)C
(2)B
(3)D
14. 某小型化工厂生产皓矾(ZnSO₄·7H₂O)的工艺流程如下图所示:

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)₃:2.7~3.7;Fe(OH)₂:7.6~9.6;Zn(OH)₂:5.7~8.0。
试回答下列问题:
(1)加入的①应是__________,其目的是____________________。
(2)加入的②,供选择使用的有:氨水、NaClO溶液、20% H₂O₂溶液、浓硫酸、浓硝酸等,应选用__________,其理由是______________________________。
(3)加入的③是__________,目的是______________________________。

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)₃:2.7~3.7;Fe(OH)₂:7.6~9.6;Zn(OH)₂:5.7~8.0。
试回答下列问题:
(1)加入的①应是__________,其目的是____________________。
(2)加入的②,供选择使用的有:氨水、NaClO溶液、20% H₂O₂溶液、浓硫酸、浓硝酸等,应选用__________,其理由是______________________________。
(3)加入的③是__________,目的是______________________________。
答案:
解析:向溶液中加入Zn,发生反应:Cu²⁺ + Zn = Zn²⁺ + Cu、2Fe³⁺ + Zn = 2Fe²⁺ + Zn²⁺,然后把Fe²⁺氧化成Fe³⁺,在选择氧化剂时,应使用H₂O₂,因为H₂O₂的还原产物为H₂O,不引入新杂质,然后通过调节溶液的pH,使Fe³⁺水解生成Fe(OH)₃沉淀而除去。
答案:
(1)Zn 将Cu²⁺、Fe³⁺等杂质离子除去
(2)20% H₂O₂溶液 H₂O₂作氧化剂,可将Fe²⁺氧化为Fe³⁺,且不引入其他杂质
(3)ZnO或Zn(OH)₂(答案合理即可) 调节溶液的pH,使Fe³⁺转化为Fe(OH)₃沉淀除去
答案:
(1)Zn 将Cu²⁺、Fe³⁺等杂质离子除去
(2)20% H₂O₂溶液 H₂O₂作氧化剂,可将Fe²⁺氧化为Fe³⁺,且不引入其他杂质
(3)ZnO或Zn(OH)₂(答案合理即可) 调节溶液的pH,使Fe³⁺转化为Fe(OH)₃沉淀除去
查看更多完整答案,请扫码查看


