2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1.已知热化学方程式:
C(金刚石,s)+O₂(g)=CO₂(g) ΔH₁;
C(石墨,s)+O₂(g)=CO₂(g) ΔH₂;
C(石墨,s)=C(金刚石,s) ΔH₃ = +1.9 kJ/mol
下列说法正确的是( )
A.金刚石比石墨稳定
B.ΔH₁>ΔH₂
C.ΔH₃ = ΔH₁ - ΔH₂
D.石墨转化成金刚石的反应是吸热反应
C(金刚石,s)+O₂(g)=CO₂(g) ΔH₁;
C(石墨,s)+O₂(g)=CO₂(g) ΔH₂;
C(石墨,s)=C(金刚石,s) ΔH₃ = +1.9 kJ/mol
下列说法正确的是( )
A.金刚石比石墨稳定
B.ΔH₁>ΔH₂
C.ΔH₃ = ΔH₁ - ΔH₂
D.石墨转化成金刚石的反应是吸热反应
答案:
D 石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,A错误;石墨的能量低于金刚石的能量,故石墨燃烧放出的能量比金刚石低,放热反应的$\Delta H<0$,$\Delta H_{1}<\Delta H_{2}$,故B错误;将3个反应依次编为1式、2式、3式,根据盖斯定律,3式 = 2式 - 1式,故$\Delta H_{3}=\Delta H_{2}-\Delta H_{1}$,C错误;石墨转化为金刚石$\Delta H_{3}= + 1.9\ kJ/mol$,为吸热反应,D正确。
2.已知:
①2H₂(g)+O₂(g)=2H₂O(g) ΔH₁
②3H₂(g)+Fe₂O₃(s)=2Fe(s)+3H₂O(g) ΔH₂
③2Fe(s)+3/2O₂(g)=Fe₂O₃(s) ΔH₃
④2Al(s)+3/2O₂(g)=Al₂O₃(s) ΔH₄
⑤2Al(s)+Fe₂O₃(s)=Al₂O₃(s)+2Fe(s) ΔH₅
下列关于上述反应焓变的判断正确的是( )
A.ΔH₁<0,ΔH₃>0
B.ΔH₅<0,ΔH₄<ΔH₃
C.ΔH₁ = ΔH₂ + ΔH₃
D.ΔH₃ = ΔH₄ + ΔH₅
①2H₂(g)+O₂(g)=2H₂O(g) ΔH₁
②3H₂(g)+Fe₂O₃(s)=2Fe(s)+3H₂O(g) ΔH₂
③2Fe(s)+3/2O₂(g)=Fe₂O₃(s) ΔH₃
④2Al(s)+3/2O₂(g)=Al₂O₃(s) ΔH₄
⑤2Al(s)+Fe₂O₃(s)=Al₂O₃(s)+2Fe(s) ΔH₅
下列关于上述反应焓变的判断正确的是( )
A.ΔH₁<0,ΔH₃>0
B.ΔH₅<0,ΔH₄<ΔH₃
C.ΔH₁ = ΔH₂ + ΔH₃
D.ΔH₃ = ΔH₄ + ΔH₅
答案:
B 反应$2Fe(s)+\frac{3}{2}O_{2}(g)=Fe_{2}O_{3}(s)$为放热反应,故$\Delta H_{3}<0$,A错误;反应$2Al(s)+Fe_{2}O_{3}(s)=Al_{2}O_{3}(s)+2Fe(s)$为放热反应,$\Delta H_{5}<0$,根据盖斯定律有④ - ③ = ⑤,故$\Delta H_{5}=\Delta H_{4}-\Delta H_{3}<0$,则$\Delta H_{4}<\Delta H_{3}$,B正确,D错误;根据盖斯定律有① = (② + ③)$\times\frac{2}{3}$,故$\Delta H_{1}=(\Delta H_{2}+\Delta H_{3})\times\frac{2}{3}$,C错误。
3.在1200℃时,天然气脱硫工艺中会发生下列反应:
H₂S(g)+3/2O₂(g)=SO₂(g)+H₂O(g) ΔH₁
2H₂S(g)+SO₂(g)=3/2S₂(g)+2H₂O(g) ΔH₂
H₂S(g)+1/2O₂(g)=S(g)+H₂O(g) ΔH₃
2S(g)=S₂(g) ΔH₄
则ΔH₄的正确表达式为( )
A.ΔH₄ = 2/3(ΔH₁ + ΔH₂ - 3ΔH₃)
B.ΔH₄ = 2/3(3ΔH₃ - ΔH₁ - ΔH₂)
C.ΔH₄ = 2/3(ΔH₁ + ΔH₂ - 3ΔH₃)
D.ΔH₄ = 2/3(ΔH₁ - ΔH₂ - 3ΔH₃)
H₂S(g)+3/2O₂(g)=SO₂(g)+H₂O(g) ΔH₁
2H₂S(g)+SO₂(g)=3/2S₂(g)+2H₂O(g) ΔH₂
H₂S(g)+1/2O₂(g)=S(g)+H₂O(g) ΔH₃
2S(g)=S₂(g) ΔH₄
则ΔH₄的正确表达式为( )
A.ΔH₄ = 2/3(ΔH₁ + ΔH₂ - 3ΔH₃)
B.ΔH₄ = 2/3(3ΔH₃ - ΔH₁ - ΔH₂)
C.ΔH₄ = 2/3(ΔH₁ + ΔH₂ - 3ΔH₃)
D.ΔH₄ = 2/3(ΔH₁ - ΔH₂ - 3ΔH₃)
答案:
A 根据盖斯定律将第1个反应和第2个反应都乘以$\frac{2}{3}$后相加,再减去第3个反应的2倍就得到反应$2S(g)=S_{2}(g)$,故$\Delta H_{4}=\frac{2}{3}(\Delta H_{1}+\Delta H_{2}) - 2\Delta H_{3}$,即答案为A。
4.太阳能的开发与利用是能源领域的一个重要研究方向,由CO₂制取C的太阳能工艺如图所示,下列有关说法正确的是(Nₐ代表阿伏加德罗常数的值)( )

A.分解1 mol Fe₃O₄转移的电子数为2Nₐ
B.根据盖斯定律,ΔH₁ + ΔH₂ = 0
C.FeO在CO₂转化为C的过程中起催化作用
D.该工艺将太阳能转化为电能

A.分解1 mol Fe₃O₄转移的电子数为2Nₐ
B.根据盖斯定律,ΔH₁ + ΔH₂ = 0
C.FeO在CO₂转化为C的过程中起催化作用
D.该工艺将太阳能转化为电能
答案:
A $Fe_{3}O_{4}$分解生成$FeO$和$O_{2}$,$FeO$与$CO_{2}$反应生成$Fe_{3}O_{4}$和$C$,两个反应不互为逆反应,所以$\Delta H_{1}+\Delta H_{2}\neq0$,B项错误;在$CO_{2}$转化为$C$的过程中$Fe$元素的化合价升高,则$FeO$失电子作还原剂,C项错误;该工艺将太阳能转化为化学能,D项错误。
5.根据图中的能量关系,可求得C—H的键能为( )

A.414 kJ/mol
B.377 kJ/mol
C.235 kJ/mol
D.197 kJ/mol

A.414 kJ/mol
B.377 kJ/mol
C.235 kJ/mol
D.197 kJ/mol
答案:
A 由能量关系图,$C(s)$键能为$717\ kJ/mol$,$H_{2}$键能为$(864\div2)kJ/mol = 432\ kJ/mol$,$C(s)+2H_{2}(g)=CH_{4}(g)$ $\Delta H=-75\ kJ/mol$,设$C - H$的键能为$x$,则反应热$\Delta H =$反应物总键能 - 生成物总键能$=(717\ kJ/mol + 432\ kJ/mol\times2)-4x=-75\ kJ/mol$,解得$x = 414\ kJ/mol$。
6.(1)“垃圾是放错了地方的资源”。用H₂O₂和H₂SO₄的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H⁺(aq)=Cu²⁺(aq)+H₂(g) ΔH = +64 kJ/mol
2H₂O₂(l)=2H₂O(l)+O₂(g) ΔH = -196 kJ/mol
H₂(g)+1/2O₂(g)=H₂O(l) ΔH = -286 kJ/mol
则反应Cu(s)+H₂O₂(l)+2H⁺(aq)=Cu²⁺(aq)+2H₂O(l)的反应热ΔH等于________。
(2)工业上制取硝酸铵的流程图如图所示:
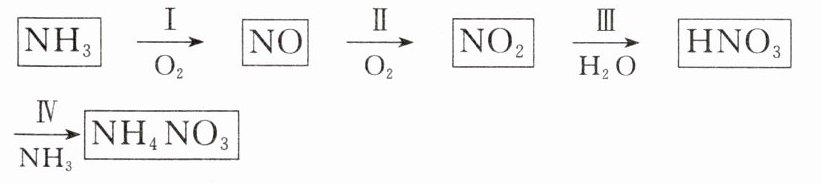
请回答下列问题:
已知:4NO(g)+4NH₃(g)+O₂(g)=4N₂(g)+6H₂O(g) ΔH = -a kJ/mol
6NO(g)+4NH₃(g)=5N₂(g)+6H₂O(g) ΔH = -b kJ/mol
则反应Ⅰ的热化学方程式可表示为______________________________。
Cu(s)+2H⁺(aq)=Cu²⁺(aq)+H₂(g) ΔH = +64 kJ/mol
2H₂O₂(l)=2H₂O(l)+O₂(g) ΔH = -196 kJ/mol
H₂(g)+1/2O₂(g)=H₂O(l) ΔH = -286 kJ/mol
则反应Cu(s)+H₂O₂(l)+2H⁺(aq)=Cu²⁺(aq)+2H₂O(l)的反应热ΔH等于________。
(2)工业上制取硝酸铵的流程图如图所示:

请回答下列问题:
已知:4NO(g)+4NH₃(g)+O₂(g)=4N₂(g)+6H₂O(g) ΔH = -a kJ/mol
6NO(g)+4NH₃(g)=5N₂(g)+6H₂O(g) ΔH = -b kJ/mol
则反应Ⅰ的热化学方程式可表示为______________________________。
答案:
(1)$-320\ kJ/mol$
(2)$4NH_{3}(g)+5O_{2}(g)=4NO(g)+6H_{2}O(g)$ $\Delta H=(-5a + 4b)kJ/mol$
(1)$-320\ kJ/mol$
(2)$4NH_{3}(g)+5O_{2}(g)=4NO(g)+6H_{2}O(g)$ $\Delta H=(-5a + 4b)kJ/mol$
查看更多完整答案,请扫码查看


