2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第24页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
12.2SO₂+O₂$\rightleftharpoons$2SO₃进行的时间t和反应混合气中SO₃的质量分数的关系如图所示。曲线P表示使用了催化剂,曲线Q表示未使用催化剂。从图中可知,催化剂可以____________________,但不能____________________。


答案:
加快反应速率 改变SO₃的质量分数
13.KClO₃和KHSO₃能发生反应:ClO₃⁻+HSO₃⁻$\longrightarrow$SO₄²⁻+Cl⁻+H⁺(未配平)。已知该反应的速率随c(H⁺)的增大而加快。如图为用ClO₃⁻在单位时间内物质的量浓度变化表示的该反应v -t图。下列说法不正确的是( )

A.反应开始时速率增大可能是c(H⁺)所致
B.纵坐标为v(Cl⁻)的v -t曲线与图中曲线不能完全重合
C.后期速率v下降的主要原因是反应物的浓度减小
D.图中阴影部分的“面积”可以表示t₁~t₂时间段内c(ClO₃⁻)的减少量

A.反应开始时速率增大可能是c(H⁺)所致
B.纵坐标为v(Cl⁻)的v -t曲线与图中曲线不能完全重合
C.后期速率v下降的主要原因是反应物的浓度减小
D.图中阴影部分的“面积”可以表示t₁~t₂时间段内c(ClO₃⁻)的减少量
答案:
B 由反应原理可知,反应开始后,随着反应的进行,c(H⁺)不断增大,故反应开始时速率增大可能是c(H⁺)所致,A正确;生成物中Cl⁻是反应物ClO₃⁻的还原产物,据Cl原子守恒可知,方程式中Cl⁻、ClO₃⁻的化学计量数之比为1∶1,根据反应速率与化学计量数的关系推知,纵坐标为v(Cl⁻)的v - t曲线与图中曲线能完全重合,B错误;随着反应的进行,反应物的浓度减小,故后期反应速率下降的主要原因是反应物浓度减小,C正确;该图为v - t图,v = Δc/Δt可得Δc = v·Δt,故图中阴影“面积”可以表示t₁~t₂时间内c(ClO₃⁻)的减少量,D正确。
14.酸性条件下,KMnO₄与H₂C₂O₄发生氧化还原反应,用0.1 mol·L⁻¹的KMnO₄溶液与过量的H₂C₂O₄溶液反应,测得Mn²⁺的生成速率v与时间t的关系如图,下列说法正确的是( )

A.该反应中每生成1 mol CO₂转移10 mol电子
B.在该反应的离子方程式中,H₂O的化学计量数为6
C.反应开始很短一段时间内v减小是因为反应物浓度减小,后来突然增大是因为生成的Mn²⁺对该反应有催化作用
D.t₀时,Mn²⁺的浓度最大

A.该反应中每生成1 mol CO₂转移10 mol电子
B.在该反应的离子方程式中,H₂O的化学计量数为6
C.反应开始很短一段时间内v减小是因为反应物浓度减小,后来突然增大是因为生成的Mn²⁺对该反应有催化作用
D.t₀时,Mn²⁺的浓度最大
答案:
C 高锰酸钾溶液与草酸反应的离子方程式为2MnO₄⁻ + 6H⁺ + 5H₂C₂O₄ = 2Mn²⁺ + 10CO₂↑ + 8H₂O,由此可知每生成1 mol CO₂转移1 mol电子,H₂O的化学计量数应该为8,A、B错误;反应开始后,反应物浓度逐渐减小,反应速率减小,但是反应生成的Mn²⁺在浓度达到一定大小后,对该反应有催化作用,所以反应速率会突然增大,随着反应的进行,反应物的浓度不断减小,浓度成为速率的主要影响因素,反应速率则不断减小,C正确;t₀时,生成Mn²⁺的反应速率最大,但t₀后反应还在正向进行,Mn²⁺的浓度继续增大,D错误。
15.一定温度下,向10 mL 0.40 mol·L⁻¹ H₂O₂溶液中加入适量FeCl₃溶液,不同时刻测得生成O₂的体积(已折算为标准状况)如下表所示。

资料显示,反应分两步进行:①2Fe³⁺+H₂O₂$\stackrel{}{=\!=\!=}$2Fe²⁺+O₂↑+2H⁺,②H₂O₂+2Fe²⁺+2H⁺$\stackrel{}{=\!=\!=}$2H₂O+2Fe³⁺。反应过程中能量变化如图所示。下列说法错误的是( )
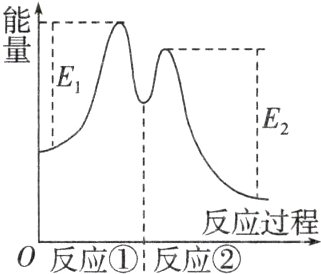
A.Fe³⁺的作用是增大过氧化氢的分解速率
B.反应①是吸热反应、反应②是放热反应
C.反应2H₂O₂(aq)$\stackrel{}{=\!=\!=}$2H₂O(l)+O₂(g)的$\Delta H=E₁ - E₂<0$
D.0~6 min的平均反应速率v(H₂O₂)≈3.33×10⁻² mol·L⁻¹·min⁻¹

资料显示,反应分两步进行:①2Fe³⁺+H₂O₂$\stackrel{}{=\!=\!=}$2Fe²⁺+O₂↑+2H⁺,②H₂O₂+2Fe²⁺+2H⁺$\stackrel{}{=\!=\!=}$2H₂O+2Fe³⁺。反应过程中能量变化如图所示。下列说法错误的是( )

A.Fe³⁺的作用是增大过氧化氢的分解速率
B.反应①是吸热反应、反应②是放热反应
C.反应2H₂O₂(aq)$\stackrel{}{=\!=\!=}$2H₂O(l)+O₂(g)的$\Delta H=E₁ - E₂<0$
D.0~6 min的平均反应速率v(H₂O₂)≈3.33×10⁻² mol·L⁻¹·min⁻¹
答案:
C 由反应① + ②可得总反应的化学方程式为2H₂O₂ = 2H₂O + O₂↑,故Fe³⁺是催化剂,可增大H₂O₂的分解速率,故A正确;反应①中生成物的总能量大于反应物的总能量,是吸热反应,反应②中生成物的总能量小于反应物的总能量,是放热反应,故B正确;焓变 = 生成物的总能量 - 反应物的总能量,由题图可知反应2H₂O₂(aq) = 2H₂O(l) + O₂(g)的ΔH≠E₁ - E₂,故C错误;0~6 min生成O₂的物质的量是0.001 mol,消耗H₂O₂的物质的量是0.001 mol×2 = 0.002 mol,所以v(H₂O₂) = 0.002 mol/(0.01 L×6 min)≈3.33×10⁻² mol·L⁻¹·min⁻¹,故D正确。
16.某反应过程的能量变化关系如图所示,按要求回答下列问题:

(1)已知热化学方程式H₂(g)+$\frac{1}{2}$O₂(g)$\stackrel{}{=\!=\!=}$H₂O(g) $\Delta H=-241.8$ kJ·mol⁻¹,该反应的活化能为167.2 kJ·mol⁻¹,则其逆反应的活化能为________。
(2)已知C(石墨,s)$\stackrel{}{=\!=\!=}$C(金刚石,s) $\Delta H=+1.5$ kJ·mol⁻¹,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石的反应很容易进行,但事实上该反应却很难发生,需要很高的温度和很大的压强,请你分析造成这种现象的主要因素是______________________________。
(3)对于同一反应,图中虚线Ⅱ与实线Ⅰ相比,活化能降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是__________________________。

(1)已知热化学方程式H₂(g)+$\frac{1}{2}$O₂(g)$\stackrel{}{=\!=\!=}$H₂O(g) $\Delta H=-241.8$ kJ·mol⁻¹,该反应的活化能为167.2 kJ·mol⁻¹,则其逆反应的活化能为________。
(2)已知C(石墨,s)$\stackrel{}{=\!=\!=}$C(金刚石,s) $\Delta H=+1.5$ kJ·mol⁻¹,某同学根据该反应吸收的热量较小,认为由石墨变为金刚石的反应很容易进行,但事实上该反应却很难发生,需要很高的温度和很大的压强,请你分析造成这种现象的主要因素是______________________________。
(3)对于同一反应,图中虚线Ⅱ与实线Ⅰ相比,活化能降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是__________________________。
答案:
(1)409.0 kJ·mol⁻¹
(2)该反应的活化能很高
(3)使用了催化剂
(1)409.0 kJ·mol⁻¹
(2)该反应的活化能很高
(3)使用了催化剂
查看更多完整答案,请扫码查看


