2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
2.为比较$Fe^{3+}$和$Cu^{2+}$对$H_{2}O_{2}$分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是 ( )
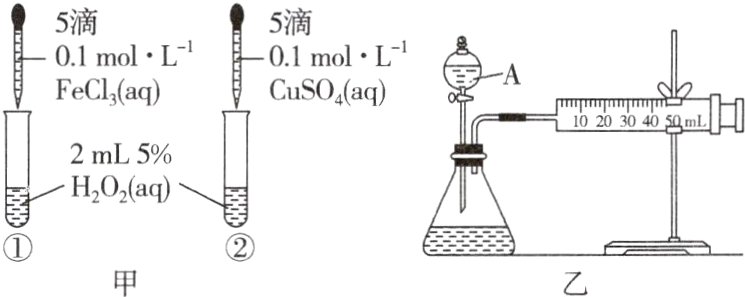
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明$Fe^{3+}$比$Cu^{2+}$对$H_{2}O_{2}$分解催化效果好
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明$Fe^{3+}$比$Cu^{2+}$对$H_{2}O_{2}$分解催化效果好
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
答案:
B 其他条件相同,产生气泡快,说明反应速率快,催化剂的催化效果好,A正确;图甲中分别加入FeCl₃、CuSO₄溶液,c(Fe³⁺)和c(Cu²⁺)相同,但所含阴离子不同,反应速率为①>②,并不能说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好,B 错误;利用图乙装置,通过测定产生O₂的体积及所需时间,确定反应速率,C正确;检查装置乙的气密性,关闭A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞恢复原位,则该装置的气密性良好,否则,气密性不好,D 正确。
3.为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
|实验序号|体积V/mL| | | | |
| ---- | ---- | ---- | ---- | ---- | ---- |
| |$K_{2}S_{2}O_{8}$溶液|水|KI溶液|$Na_{2}S_{2}O_{3}$溶液|淀粉溶液|
|①|10.0|0.0|4.0|4.0|2.0|
|②|9.0|1.0|4.0|4.0|2.0|
|③|8.0|$V_{x}$|4.0|4.0|2.0|
表中$V_{x}=$____mL,理由是____。
|实验序号|体积V/mL| | | | |
| ---- | ---- | ---- | ---- | ---- | ---- |
| |$K_{2}S_{2}O_{8}$溶液|水|KI溶液|$Na_{2}S_{2}O_{3}$溶液|淀粉溶液|
|①|10.0|0.0|4.0|4.0|2.0|
|②|9.0|1.0|4.0|4.0|2.0|
|③|8.0|$V_{x}$|4.0|4.0|2.0|
表中$V_{x}=$____mL,理由是____。
答案:
解析:对照实验探究浓度对反应速率的影响须保证其他条件完全一致,故应加水2.0 mL,以保证溶液体积相同。
答案:2.0 保证反应物K₂S₂O₈的浓度改变,而其他物质浓度不变
答案:2.0 保证反应物K₂S₂O₈的浓度改变,而其他物质浓度不变
4.下列各组反应(表中物质均为反应物),反应刚开始时,放出$H_{2}$的速率最大的是 ( )
|编号|金属(粉末状)|酸的浓度及体积|反应温度|
| ---- | ---- | ---- | ---- |
|A|$Mg:0.1\ mol$|$6\ mol\cdot L^{-1}\ HNO_{3}$ 10 mL|$60^{\circ}C$|
|B|$Mg:0.1\ mol$|$3\ mol\cdot L^{-1}\ HCl$ 10 mL|$60^{\circ}C$|
|C|$Fe:0.1\ mol$|$3\ mol\cdot L^{-1}\ HCl$ 10 mL|$60^{\circ}C$|
|D|$Mg:0.1\ mol$|$3\ mol\cdot L^{-1}\ H_{2}SO_{4}$ 10 mL|$60^{\circ}C$|
|编号|金属(粉末状)|酸的浓度及体积|反应温度|
| ---- | ---- | ---- | ---- |
|A|$Mg:0.1\ mol$|$6\ mol\cdot L^{-1}\ HNO_{3}$ 10 mL|$60^{\circ}C$|
|B|$Mg:0.1\ mol$|$3\ mol\cdot L^{-1}\ HCl$ 10 mL|$60^{\circ}C$|
|C|$Fe:0.1\ mol$|$3\ mol\cdot L^{-1}\ HCl$ 10 mL|$60^{\circ}C$|
|D|$Mg:0.1\ mol$|$3\ mol\cdot L^{-1}\ H_{2}SO_{4}$ 10 mL|$60^{\circ}C$|
答案:
D 硝酸与镁反应不生成氢气,Mg比Fe活泼,与酸反应较剧烈;B和D相比较,D氢离子浓度较大,反应速率较快。
5.在四支试管中发生反应:$Mg + 2HCl = MgCl_{2} + H_{2}\uparrow$,生成$H_{2}$的速率最大的是 ( )
|试管|等质量镁的形状|盐酸的浓度($mol\cdot L^{-1}$)|温度($^{\circ}C$)|
| ---- | ---- | ---- | ---- |
|A|条状|0.1|30|
|B|条状|0.1|40|
|C|粉末状|0.1|40|
|D|粉末状|0.5|40|
|试管|等质量镁的形状|盐酸的浓度($mol\cdot L^{-1}$)|温度($^{\circ}C$)|
| ---- | ---- | ---- | ---- |
|A|条状|0.1|30|
|B|条状|0.1|40|
|C|粉末状|0.1|40|
|D|粉末状|0.5|40|
答案:
D 浓度越大,温度越高,固体的表面积越大,则反应速率越大,对比表中数据可知D盐酸浓度最大,固体呈粉末状,温度也是最高,则反应速率最大。
6.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是 ( )
A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B.盛有相同浓度双氧水的两支试管,一支加入$MnO_{2}$放在冷水中,一支直接放在冷水中,前者反应快
C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D.升高温度,$H_{2}O_{2}$的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B.盛有相同浓度双氧水的两支试管,一支加入$MnO_{2}$放在冷水中,一支直接放在冷水中,前者反应快
C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D.升高温度,$H_{2}O_{2}$的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
答案:
A 影响化学反应速率的主要因素是反应物的性质,镁、铝的活泼性不同,故两者与同浓度的盐酸反应快慢不同。
7.影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
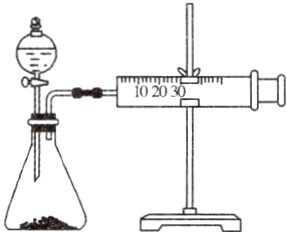
药品:$Cu$、$Fe$、$Na$和不同浓度的硫酸($0.5\ mol\cdot L^{-1}$、$2\ mol\cdot L^{-1}$、$18.4\ mol\cdot L^{-1}$);
(1)用此装置进行定量实验,应选用的上述实验药品是:
第一组:____和____。
第二组:____和____。
(2)应该测定的实验数据是气体从反应开始到推动活塞达到30 mL刻度时的____。
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):____。
(4)此实验得到的结论应该是硫酸的浓度越____,反应速率越____。(填“高”“低”“快”“慢”)

药品:$Cu$、$Fe$、$Na$和不同浓度的硫酸($0.5\ mol\cdot L^{-1}$、$2\ mol\cdot L^{-1}$、$18.4\ mol\cdot L^{-1}$);
(1)用此装置进行定量实验,应选用的上述实验药品是:
第一组:____和____。
第二组:____和____。
(2)应该测定的实验数据是气体从反应开始到推动活塞达到30 mL刻度时的____。
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):____。
(4)此实验得到的结论应该是硫酸的浓度越____,反应速率越____。(填“高”“低”“快”“慢”)
答案:
解析:
(1)用此装置进行定量实验,应选用的上述实验药品是Fe、0.5 mol·L⁻¹硫酸和Fe、2 mol·L⁻¹硫酸,只控制硫酸的浓度不同;
(2)测定的实验数据是气体从反应开始到推动活塞达到30 mL刻度时的时间;
(3)此实验忽视了影响反应速率的其他因素是温度对反应速率的影响,因金属与酸反应为放热反应;
(4)实验得到的结论应该是硫酸的浓度越高,反应速率越快。
答案:
(1)Fe 0.5 mol·L⁻¹硫酸 Fe 2 mol·L⁻¹硫酸
(2)时间
(3)温度
(4)高 快(或低 慢)
(1)用此装置进行定量实验,应选用的上述实验药品是Fe、0.5 mol·L⁻¹硫酸和Fe、2 mol·L⁻¹硫酸,只控制硫酸的浓度不同;
(2)测定的实验数据是气体从反应开始到推动活塞达到30 mL刻度时的时间;
(3)此实验忽视了影响反应速率的其他因素是温度对反应速率的影响,因金属与酸反应为放热反应;
(4)实验得到的结论应该是硫酸的浓度越高,反应速率越快。
答案:
(1)Fe 0.5 mol·L⁻¹硫酸 Fe 2 mol·L⁻¹硫酸
(2)时间
(3)温度
(4)高 快(或低 慢)
查看更多完整答案,请扫码查看


