2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
二、化学反应的调控
影响化学反应进行的因素有两个方面:参加反应的物质______(组成、结构、性质等)和______(温度、压强、浓度、催化剂等)。化学反应的调控,就是通过改变外界条件使一个可能发生的反应按照某一方向进行。在实际生产中,要综合考虑______和______的因素,寻找一个适宜的生产条件。
影响化学反应进行的因素有两个方面:参加反应的物质______(组成、结构、性质等)和______(温度、压强、浓度、催化剂等)。化学反应的调控,就是通过改变外界条件使一个可能发生的反应按照某一方向进行。在实际生产中,要综合考虑______和______的因素,寻找一个适宜的生产条件。
答案:
本身因素 外界条件 化学反应速率 化学平衡
1.对于合成氨工业,只从提高原料转化率看,从下列条件中选择最适宜的组合是 ( )
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨
A.②④⑤
B.②④⑦
C.①④⑤
D.②③⑥
①高温 ②低温 ③低压 ④高压 ⑤催化剂 ⑥加氨 ⑦除氨
A.②④⑤
B.②④⑦
C.①④⑤
D.②③⑥
答案:
B N₂ + 3H₂⇌2NH₃ △H<0,反应是气体体积减小的放热反应,从勒夏特列原理分析可知高温下,平衡逆向进行,反应物转化率减小,故①错误;低温条件下,平衡正向进行,反应物转化率增大,故②正确;反应是气体体积减小的反应,低压平衡逆向进行,反应物转化率减小,故③错误;在高压条件下,平衡正向进行,反应物转化率增大,故④正确;催化剂改变反应速率不改变化学平衡,反应物转化率不变,故⑤错误;加入氨气平衡逆向进行,转化率减小,故⑥错误;除氨减小生成物浓度,平衡正向进行,反应物转化率增大,故⑦正确。
2.下列关于工业合成氨的叙述正确的是 ( )
A.合成氨工业温度选择为700 K左右,主要是为了提高NH₃产率
B.使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响
C.合成氨生产过程中将NH₃液化分离,可提高N₂、H₂的转化率
D.合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度
A.合成氨工业温度选择为700 K左右,主要是为了提高NH₃产率
B.使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响
C.合成氨生产过程中将NH₃液化分离,可提高N₂、H₂的转化率
D.合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度
答案:
C 合成氨反应为放热反应,温度较高不利于提高NH₃产率,故A错误;催化剂和高压能加快反应速率,增大压强平衡正移,催化剂对平衡无影响,故B错误;减少生成物的浓度平衡正向移动,所以将NH₃液化分离,可提高N₂、H₂的转化率,故C正确;增加一种反应物的浓度可以提高另一种反应物的转化率,而本身转化率降低,所以合成氨工业中为了提高氢气的利用率,可适当增加氮气的浓度,故D错误。
3.如图是工业合成氨的简单流程图,沿①路线回流的物质是 ( )
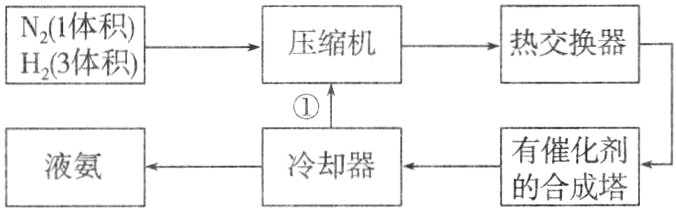
A.氮气和氢气
B.催化剂
C.NH₃
D.H₂

A.氮气和氢气
B.催化剂
C.NH₃
D.H₂
答案:
A 合成氨工业中,利用氨易液化,分离出N₂、H₂循环使用,可使平衡向正反应方向移动,则氨气的产率增大,所以沿路线回去的物质是N₂、H₂。
4.合成氨反应[$N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)\ \ \Delta H=-92.4\ kJ/mol$]在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
(1)X的化学式为______;X的状态为______态。
(2)据图分析,下列说法正确的是______(填字母)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作

(1)X的化学式为______;X的状态为______态。
(2)据图分析,下列说法正确的是______(填字母)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作

答案:
解析:
(1)合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,从图中生产流程知,原料气氮气和氢气,经过氨的合成、氨的分离,所以X为液态的氨气,Y为氮气和氢气的混合气,再循环利用;
(2)升高温度,能使反应速率加快,但该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,不利于氨的合成,故a不选;铁触媒的使用有利于加快反应速率,但平衡不移动,故b不选;增大压强,能使反应速率加快,反应也向正反应方向移动,但过高的压强,反应成本高,故选c;为提高原料的转化率,采用循环操作,提高原料的利用率,故选d。
答案:
(1)NH₃ 液
(2)cd
(1)合成氨工业有下列流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,从图中生产流程知,原料气氮气和氢气,经过氨的合成、氨的分离,所以X为液态的氨气,Y为氮气和氢气的混合气,再循环利用;
(2)升高温度,能使反应速率加快,但该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,不利于氨的合成,故a不选;铁触媒的使用有利于加快反应速率,但平衡不移动,故b不选;增大压强,能使反应速率加快,反应也向正反应方向移动,但过高的压强,反应成本高,故选c;为提高原料的转化率,采用循环操作,提高原料的利用率,故选d。
答案:
(1)NH₃ 液
(2)cd
5.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应$2SO_{2}+O_{2}\underset{\triangle }{\overset{催化剂}{\rightleftharpoons }}2SO_{3}$的说法中不正确的是 ( )
A.实际生产中,SO₂、O₂再循环使用提高原料利用率
B.实际生产中,为了提高经济效益压强越高越好
C.在生产中,通入过量空气的目的是提高SO₂的转化率
D.实际生产中,选定400~500℃作为操作温度的主要原因是此温度下催化剂的活性最高
A.实际生产中,SO₂、O₂再循环使用提高原料利用率
B.实际生产中,为了提高经济效益压强越高越好
C.在生产中,通入过量空气的目的是提高SO₂的转化率
D.实际生产中,选定400~500℃作为操作温度的主要原因是此温度下催化剂的活性最高
答案:
B SO₂、O₂再循环使用可避免污染,提高利用率,故A正确;压强不能过大,在常压下转化率已经很大,且应考虑设备的承受力,故B错误;氧气过量,可使平衡正向移动,可提高SO₂的转化率,故C正确;正反应为放热反应,操作温度应考虑催化剂的活性以及反应的速率,故D正确。
6.对下列化工生产认识正确的是 ( )
A.制备硫酸:使用热交换器可以充分利用能量
B.侯德榜制碱:析出NaHCO₃的母液中加入消石灰,可以循环利用NH₃
C.合成氨:采用500℃的高温,有利于增大反应正向进行的程度
D.合成氯化氢:通入H₂的量略大于Cl₂,可以使平衡正向移动
A.制备硫酸:使用热交换器可以充分利用能量
B.侯德榜制碱:析出NaHCO₃的母液中加入消石灰,可以循环利用NH₃
C.合成氨:采用500℃的高温,有利于增大反应正向进行的程度
D.合成氯化氢:通入H₂的量略大于Cl₂,可以使平衡正向移动
答案:
A 制硫酸时使用热交换器,可充分利用能量,故A正确;侯德榜制碱法:析出NaHCO₃的母液中加入生石灰,可以循环利用NH₃,故B错误;合成氨为放热反应,加热使平衡逆向移动,故C错误;氢气与氯气反应生成氯化氢不是可逆反应,不存在化学平衡的移动,故D错误。
7.合成氨的温度和压强通常控制在约500℃以及20~50 MPa的范围,且进入合成塔的N₂和H₂的体积比为1∶3,经科学测定,在相应条件下,N₂和H₂反应所得氨的平衡浓度(体积分数)如下表所示。

而实际从合成塔出来的混合气体中含有氨约为15%,这表明 ( )
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应并未达到平衡

而实际从合成塔出来的混合气体中含有氨约为15%,这表明 ( )
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应并未达到平衡
答案:
D 表中数据为科学家通过科学实验所得,不会存在明显误差,故A错误;合成氨生成过程是连续的,不会对生产条件控制不当,故B错误;氨气平衡时的浓度大小与速率的大小没有直接关系,若是分解速率的影响,可以通过改变条件,降低分解速率,但无论在任何条件下氨气的体积分数都会低于预测值,说明与氨气的分解速率无关,故C错误;从合成塔出来的混合气体中含有氨约为15%,与科学测定结果相比偏低,只能说明合成塔中的可逆反应并没有达到平衡状态,故D 正确。
查看更多完整答案,请扫码查看


