2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
10. 用酚酞试液作指示剂,对某新制NaOH溶液进行中和滴定实验,数据记录如下表:

则该新制NaOH溶液的浓度c为 ( )
A. $\frac{0.01×(V₁+V₂+V₃)}{3×20}$ mol/L
B. $\frac{0.01×(V₁+V₂)}{2×20}$ mol/L
C. $\frac{0.01×(V₁+V₃)}{2×20}$ mol/L
D. $\frac{0.01×V₁}{20}$ mol/L

则该新制NaOH溶液的浓度c为 ( )
A. $\frac{0.01×(V₁+V₂+V₃)}{3×20}$ mol/L
B. $\frac{0.01×(V₁+V₂)}{2×20}$ mol/L
C. $\frac{0.01×(V₁+V₃)}{2×20}$ mol/L
D. $\frac{0.01×V₁}{20}$ mol/L
答案:
B 酸碱中和滴定实验一般重复2~3次,取体积的平均值用于计算待测液的浓度,故D项不正确;用酚酞作指示剂时,敞口放置的NaOH吸收CO₂生成Na₂CO₃,和盐酸滴定Na₂CO₃溶液,反应分两个阶段进行:
(1)H⁺ + CO₃²⁻ = HCO₃⁻;
(2)H⁺ + HCO₃⁻ = CO₂↑ + H₂O,酚酞变色范围为pH在8~10,滴定反应按
(1)进行,使所耗盐酸的体积偏小,故求待测液浓度时只能用V₁、V₂进行计算。
(1)H⁺ + CO₃²⁻ = HCO₃⁻;
(2)H⁺ + HCO₃⁻ = CO₂↑ + H₂O,酚酞变色范围为pH在8~10,滴定反应按
(1)进行,使所耗盐酸的体积偏小,故求待测液浓度时只能用V₁、V₂进行计算。
11. 某同学用中和滴定法测定某烧碱溶液的浓度。
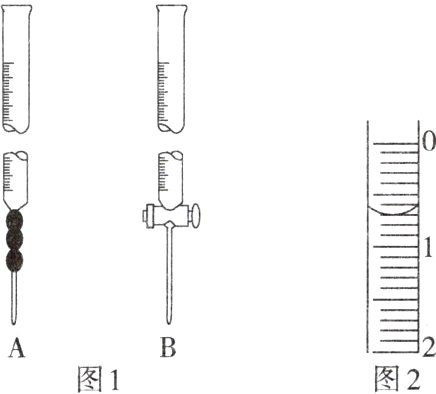
Ⅰ. 实验步骤
(1)用图1中仪器________(填“A”和“B”)取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.1000 mol·L⁻¹盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为________mL。
(3)滴定。滴定过程中,眼睛应始终注视________。
(4)滴定终点的现象是__________________________
Ⅱ. 数据记录

Ⅲ. 数据处理
(5)计算该烧碱溶液的浓度c(NaOH)=______mol·L⁻¹(精确到小数点后4位)。
Ⅳ. 误差分析
(6)以下操作会导致测定结果偏高的是__________(填字母)。
A. 未用盐酸标准溶液润洗滴定管
B. 装待测液前,锥形瓶中有少量蒸馏水
C. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D. 观察读数时,滴定前仰视,滴定后俯视

Ⅰ. 实验步骤
(1)用图1中仪器________(填“A”和“B”)取待测烧碱溶液25.00 mL于锥形瓶中,滴加2滴酚酞作指示剂。
(2)记录盛装0.1000 mol·L⁻¹盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为________mL。
(3)滴定。滴定过程中,眼睛应始终注视________。
(4)滴定终点的现象是__________________________
Ⅱ. 数据记录

Ⅲ. 数据处理
(5)计算该烧碱溶液的浓度c(NaOH)=______mol·L⁻¹(精确到小数点后4位)。
Ⅳ. 误差分析
(6)以下操作会导致测定结果偏高的是__________(填字母)。
A. 未用盐酸标准溶液润洗滴定管
B. 装待测液前,锥形瓶中有少量蒸馏水
C. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D. 观察读数时,滴定前仰视,滴定后俯视
答案:
解析:
(1)取碱液应该用碱式滴定管。
(2)滴定管的精确度为0.01 mL,故读数为0.70。
(3)滴定过程中,眼睛应始终注视锥形瓶中溶液颜色的变化。
(4)因为用酚酞作指示剂,初始为红色,故终点判断为滴入最后半滴标准溶液后,溶液由红色恰好变为无色,且半分钟内不变色。
(5)第4组读数与其他三组差别较大,属异常值,应舍去。消耗盐酸的体积为$\frac{18.05 + 18.00 + 17.95}{3}$mL = 18.00 mL,$c(NaOH)=\frac{c(HCl)\cdot V(HCl)}{V(NaOH)}=\frac{0.1000 mol\cdot L^{-1}\times18.00 mL}{25.00 mL}=0.0720 mol\cdot L^{-1}$。
(6)A项,未用盐酸标准溶液润洗滴定管,造成盐酸浓度偏小,所用盐酸体积偏大,测定结果偏高;B项,装待测液前,锥形瓶中有少量蒸馏水,无影响;C项,滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,所用盐酸体积偏大,测定结果偏高;D项,观察读数时,滴定前仰视,滴定后俯视,造成盐酸读数偏小,结果偏小。
答案:
(1)A
(2)0.70
(3)锥形瓶中溶液颜色的变化
(4)滴入最后半滴标准溶液后,溶液由红色恰好变为无色,且半分钟内不变色
(5)0.0720
(6)AC
(1)取碱液应该用碱式滴定管。
(2)滴定管的精确度为0.01 mL,故读数为0.70。
(3)滴定过程中,眼睛应始终注视锥形瓶中溶液颜色的变化。
(4)因为用酚酞作指示剂,初始为红色,故终点判断为滴入最后半滴标准溶液后,溶液由红色恰好变为无色,且半分钟内不变色。
(5)第4组读数与其他三组差别较大,属异常值,应舍去。消耗盐酸的体积为$\frac{18.05 + 18.00 + 17.95}{3}$mL = 18.00 mL,$c(NaOH)=\frac{c(HCl)\cdot V(HCl)}{V(NaOH)}=\frac{0.1000 mol\cdot L^{-1}\times18.00 mL}{25.00 mL}=0.0720 mol\cdot L^{-1}$。
(6)A项,未用盐酸标准溶液润洗滴定管,造成盐酸浓度偏小,所用盐酸体积偏大,测定结果偏高;B项,装待测液前,锥形瓶中有少量蒸馏水,无影响;C项,滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,所用盐酸体积偏大,测定结果偏高;D项,观察读数时,滴定前仰视,滴定后俯视,造成盐酸读数偏小,结果偏小。
答案:
(1)A
(2)0.70
(3)锥形瓶中溶液颜色的变化
(4)滴入最后半滴标准溶液后,溶液由红色恰好变为无色,且半分钟内不变色
(5)0.0720
(6)AC
12. 现用盐酸标准溶液来测定NaOH溶液的浓度。实验操作如下:
①向溶液中加入2~3滴指示剂,②取20.00 mL标准溶液放入锥形瓶中,③用氢氧化钠溶液滴定至终点,④重复以上操作,⑤配制250 mL盐酸标准溶液,⑥根据实验数据计算氢氧化钠溶液的物质的量浓度。
(1)实验过程中正确的操作顺序是______________(填序号),上述操作②中使用的仪器除锥形瓶外,还需要________,用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
|滴定次数|1|2|3|4|
|----|----|----|----|----|
|V(HCl)/mL|20.00|20.00|20.00|20.00|
|V(NaOH)/mL(初读数)|0.10|0.30|0.00|0.20|
|V(NaOH)/mL(终读数)|20.08|20.30|20.80|20.22|
|V(NaOH)/mL(消耗)|19.98|20.00|20.80|20.02|
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=$\frac{19.98 + 20.00 + 20.80 + 20.02}{4}$ mL=20.20 mL。他的计算________(填“合理”或“不合理”),理由是______________________________。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a ________20.02(填“>”“<”或“=”)。

①向溶液中加入2~3滴指示剂,②取20.00 mL标准溶液放入锥形瓶中,③用氢氧化钠溶液滴定至终点,④重复以上操作,⑤配制250 mL盐酸标准溶液,⑥根据实验数据计算氢氧化钠溶液的物质的量浓度。
(1)实验过程中正确的操作顺序是______________(填序号),上述操作②中使用的仪器除锥形瓶外,还需要________,用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
|滴定次数|1|2|3|4|
|----|----|----|----|----|
|V(HCl)/mL|20.00|20.00|20.00|20.00|
|V(NaOH)/mL(初读数)|0.10|0.30|0.00|0.20|
|V(NaOH)/mL(终读数)|20.08|20.30|20.80|20.22|
|V(NaOH)/mL(消耗)|19.98|20.00|20.80|20.02|
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=$\frac{19.98 + 20.00 + 20.80 + 20.02}{4}$ mL=20.20 mL。他的计算________(填“合理”或“不合理”),理由是______________________________。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a ________20.02(填“>”“<”或“=”)。

答案:
解析:
(1)在用未知浓度的NaOH溶液滴定已知浓度的盐酸的操作中,正确的操作顺序是⑤②①③④⑥。操作②取20.00 mL标准溶液放入锥形瓶中,使用的仪器除锥形瓶外,还需要酸式滴定管;为了使滴定结果准确,可用酚酞作指示剂,以减小滴定误差。
(2)该同学的计算不合理,原因是第3次滴定时消耗NaOH溶液的体积明显偏大,偏离真实值,应舍去。根据滴定曲线可知,在二者恰好完全反应时,pH = 7,此时没有达到滴定突变(指示剂未变色),所以a<20.02。
答案:
(1)⑤②①③④⑥ 酸式滴定管 酚酞
(2)不合理 第3次滴定时消耗NaOH溶液的体积明显偏大,该值应舍去 <
(1)在用未知浓度的NaOH溶液滴定已知浓度的盐酸的操作中,正确的操作顺序是⑤②①③④⑥。操作②取20.00 mL标准溶液放入锥形瓶中,使用的仪器除锥形瓶外,还需要酸式滴定管;为了使滴定结果准确,可用酚酞作指示剂,以减小滴定误差。
(2)该同学的计算不合理,原因是第3次滴定时消耗NaOH溶液的体积明显偏大,偏离真实值,应舍去。根据滴定曲线可知,在二者恰好完全反应时,pH = 7,此时没有达到滴定突变(指示剂未变色),所以a<20.02。
答案:
(1)⑤②①③④⑥ 酸式滴定管 酚酞
(2)不合理 第3次滴定时消耗NaOH溶液的体积明显偏大,该值应舍去 <
查看更多完整答案,请扫码查看


