2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 电解质和非电解质
化合物
电解质-在水溶液里_熔融状态下______的化合物
非电解质-在水溶液里_熔融状态下______的化合物
化合物
电解质-在水溶液里_熔融状态下______的化合物
非电解质-在水溶液里_熔融状态下______的化合物
答案:
或 能导电 和 都不导电
2. 强电解质和弱电解质
(1)强电解质
概念-在水溶液中能够______的电解质
物质类别-______、______和大部分盐
(2)弱电解质
概念-在水溶液中______的电解质
物质类别-______、______和水
(1)强电解质
概念-在水溶液中能够______的电解质
物质类别-______、______和大部分盐
(2)弱电解质
概念-在水溶液中______的电解质
物质类别-______、______和水
答案:
(1)全部电离 强酸 强碱
(2)部分电离 弱酸 弱碱
(1)全部电离 强酸 强碱
(2)部分电离 弱酸 弱碱
[判一判]
(1)盐酸能导电,所以盐酸是电解质 ( )
(2)$NH_3$溶于水能导电,所以$NH_3$是电解质 ( )
(1)盐酸能导电,所以盐酸是电解质 ( )
(2)$NH_3$溶于水能导电,所以$NH_3$是电解质 ( )
答案:
(1)×
(2)×
(1)×
(2)×
1. 电解质的电离方程式
(1)强电解质
完全电离,在写电离方程式时,用“$=$”。
(2)弱电解质
部分电离,在写电离方程式时,用“$\rightleftharpoons$”。
①一元弱酸、弱碱一步电离:
如$CH_3COOH$:____________________;
$NH_3\cdot H_2O$:____________________。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如$H_2CO_3$:____________________(主),
____________________(次)。
③多元弱碱分步电离(较复杂),在中学阶段要求一步写出。
如$Fe(OH)_3$:____________________。
(1)强电解质
完全电离,在写电离方程式时,用“$=$”。
(2)弱电解质
部分电离,在写电离方程式时,用“$\rightleftharpoons$”。
①一元弱酸、弱碱一步电离:
如$CH_3COOH$:____________________;
$NH_3\cdot H_2O$:____________________。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如$H_2CO_3$:____________________(主),
____________________(次)。
③多元弱碱分步电离(较复杂),在中学阶段要求一步写出。
如$Fe(OH)_3$:____________________。
答案:
(2)①$CH_{3}COOH\rightleftharpoons CH_{3}COO^{-}+H^{+}$ $NH_{3}\cdot H_{2}O\rightleftharpoons NH_{4}^{+}+OH^{-}$ ②$H_{2}CO_{3}\rightleftharpoons H^{+}+HCO_{3}^{-}$ $HCO_{3}^{-}\rightleftharpoons H^{+}+CO_{3}^{2 - }$ ③$Fe(OH)_{3}\rightleftharpoons Fe^{3 + }+3OH^{-}$
(2)①$CH_{3}COOH\rightleftharpoons CH_{3}COO^{-}+H^{+}$ $NH_{3}\cdot H_{2}O\rightleftharpoons NH_{4}^{+}+OH^{-}$ ②$H_{2}CO_{3}\rightleftharpoons H^{+}+HCO_{3}^{-}$ $HCO_{3}^{-}\rightleftharpoons H^{+}+CO_{3}^{2 - }$ ③$Fe(OH)_{3}\rightleftharpoons Fe^{3 + }+3OH^{-}$
2. 弱电解质的电离平衡
在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到电离平衡状态。
在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到电离平衡状态。
答案:
相等
3. 弱电解质电离平衡的建立(以$CH_3COOH$电离为例)
(1)在电离初始,$c(CH_3COOH)$逐渐减小,$v$(电离)逐渐______,$c(CH_3COO^-)$与$c(H^+)$逐渐增大,$v$(结合)逐渐______。当各离子浓度不再改变,$v$(电离)______$v$(结合)$\neq0$,电离达到平衡状态;故在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到电离平衡状态。
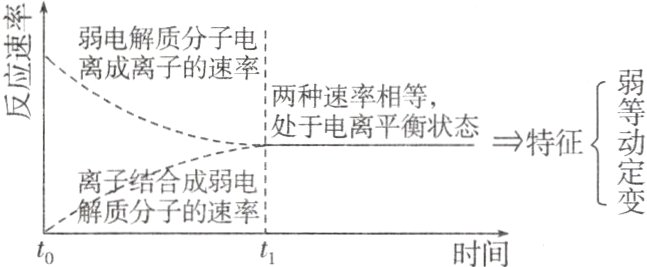
(2)电离平衡的特征

(1)在电离初始,$c(CH_3COOH)$逐渐减小,$v$(电离)逐渐______,$c(CH_3COO^-)$与$c(H^+)$逐渐增大,$v$(结合)逐渐______。当各离子浓度不再改变,$v$(电离)______$v$(结合)$\neq0$,电离达到平衡状态;故在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到电离平衡状态。

(2)电离平衡的特征

答案:
(1)减小 增大 = 相等
(2)弱电解质 相等 不变
(1)减小 增大 = 相等
(2)弱电解质 相等 不变
[判一判]
(1)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大 ( )
(2)电离平衡向右移动,弱电解质的电离程度一定增大 ( )
(3)$BaSO_4$溶于水,导电性很弱,故电离方程式为$BaSO_4\rightleftharpoons Ba^{2+}+SO_4^{2-}$ ( )
(1)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大 ( )
(2)电离平衡向右移动,弱电解质的电离程度一定增大 ( )
(3)$BaSO_4$溶于水,导电性很弱,故电离方程式为$BaSO_4\rightleftharpoons Ba^{2+}+SO_4^{2-}$ ( )
答案:
(1)×
(2)×
(3)×
(1)×
(2)×
(3)×
三、电离常数
1. 概念:在一定温度下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各离子______与未电离的分子的______的比是一个常数。
2. 表达式:对于$HA\rightleftharpoons H^++A^-$,$K =$____________________。
3. $K$的意义
$K$值越大,电解质越易电离。$K$的大小能反映弱电解质的____________________。
4. 影响因素
(1)同一弱电解质的稀溶液,电离平衡常数只与______有关,升高______,$K$值增大。
(2)在相同条件下,不同弱电解质的电离常数越大,酸性(或碱性)______。
(3)多元弱酸(或弱碱)各步电离的电离常数的大小关系是$K_1\gg K_2$,所以其酸性(或碱性)决定于第______步电离。
1. 概念:在一定温度下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各离子______与未电离的分子的______的比是一个常数。
2. 表达式:对于$HA\rightleftharpoons H^++A^-$,$K =$____________________。
3. $K$的意义
$K$值越大,电解质越易电离。$K$的大小能反映弱电解质的____________________。
4. 影响因素
(1)同一弱电解质的稀溶液,电离平衡常数只与______有关,升高______,$K$值增大。
(2)在相同条件下,不同弱电解质的电离常数越大,酸性(或碱性)______。
(3)多元弱酸(或弱碱)各步电离的电离常数的大小关系是$K_1\gg K_2$,所以其酸性(或碱性)决定于第______步电离。
答案:
浓度的乘积 浓度
@@$\frac{c(H^{+})\cdot c(A^{-})}{c(HA)}$
@@相对强弱
@@
(1)温度 温度
(2)越强
(3)一
@@$\frac{c(H^{+})\cdot c(A^{-})}{c(HA)}$
@@相对强弱
@@
(1)温度 温度
(2)越强
(3)一
查看更多完整答案,请扫码查看


