2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
8.1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要$20~50\ MPa$的高压和$500^{\circ}C$的高温下,用铁作催化剂,且氨的产率为$10\%~15\%$。2005年美国俄勒冈大学的化学家使用了一种名为$transFe(DMeOPrPE)_{2}Cl_{2}$的铁化合物作催化剂,在常温常压下合成出氨,反应可表示为$N_{2}+3H_{2}\rightleftharpoons 2NH_{3}$,下列有关说法正确的是( )
A.不同的催化剂对反应物转化率的影响不相同
B.哈伯法合成氨是吸热反应,新法合成氨是放热反应
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
A.不同的催化剂对反应物转化率的影响不相同
B.哈伯法合成氨是吸热反应,新法合成氨是放热反应
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
答案:
D 不同的催化剂机理不同,效果也不同,但在其他条件相同时,转化率是一样的,故A错误;新法合成与哈伯法合成都是反应物总能量大于生成物总能量,所以都是放热反应,只是新法降低了反应所需的能量,减少能源消耗,故B错误;新法实际上是降低了反应所需的能量,旧化学键要断裂、新化学键也同时生成,反应的本质与催化剂无关,故C错误;高温条件需要大量能源,用transFe (DMeOPrPE)₂Cl₂作催化剂,在常温常压下合成出氨,减少能源消耗,所以新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景,故D正确。
9.2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔,以表彰其在固体表面化学研究领域作出的开拓性贡献。如图是氢气与氮气在固体催化剂表面合成氨的反应过程示意图,下列有关合成氨反应的叙述中不正确的是( )

A.过程②需吸收能量、过程③放出能量
B.常温下该反应难以进行,是因为常温下反应物的化学键难以断裂
C.在催化剂的作用下,该反应的$\Delta H$变小而使反应变得更容易发生
D.该过程表明,在化学反应中存在化学键的断裂与形成

A.过程②需吸收能量、过程③放出能量
B.常温下该反应难以进行,是因为常温下反应物的化学键难以断裂
C.在催化剂的作用下,该反应的$\Delta H$变小而使反应变得更容易发生
D.该过程表明,在化学反应中存在化学键的断裂与形成
答案:
C 过程②为分子中的化学键断裂生成原子需吸收能量,过程③原子重新组合成分子需放出能量,故A正确;因为氮气中含氮氮叁键,键能大,所以常温下该反应难以进行,是因为常温下反应物的化学键难以断裂,故B正确;ΔH与反应条件无关,在催化剂的作用下,该反应的ΔH仍然不变,故C错误;该过程表明,化学反应中首先是旧化学键的断裂,然后是新化学键的形成,故D正确。
10.工业合成氨的反应:$N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H<0$。下图是当反应器中按$n(N_{2}):n(H_{2})=1:3$投料后,在$200^{\circ}C$、$400^{\circ}C$、$600^{\circ}C$下,反应达到平衡时,混合物中$NH_{3}$的物质的量分数随压强的变化曲线。
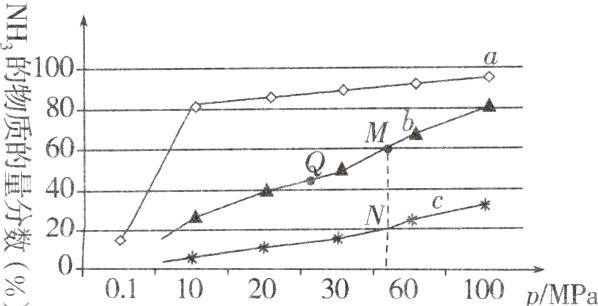
下列叙述错误的是( )
A.上图中$M$、$N$、$Q$点平衡常数$K$的大小关系为$K(M)=K(Q)>K(N)$
B.加催化剂能加快反应速率但$H_{2}$的平衡转化率不变
C.相同压强下,投料相同,达到平衡消耗时间关系为$a>b>c$
D.由曲线$a$可知,当压强增加到$100\ MPa$以上时,$NH_{3}$的物质的量分数可达到$100\%$

下列叙述错误的是( )
A.上图中$M$、$N$、$Q$点平衡常数$K$的大小关系为$K(M)=K(Q)>K(N)$
B.加催化剂能加快反应速率但$H_{2}$的平衡转化率不变
C.相同压强下,投料相同,达到平衡消耗时间关系为$a>b>c$
D.由曲线$a$可知,当压强增加到$100\ MPa$以上时,$NH_{3}$的物质的量分数可达到$100\%$
答案:
D K只受温度影响,温度不变平衡常数不变,所以K(M)=K(Q),正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,Q点的温度低于N,所以K(Q)>K(N),故A正确;加催化剂能加快反应速率但平衡不移动,所以H₂的平衡转化率不变,故B正确;相同压强下,投料相同,温度越高反应速率越快,达到平衡消耗时间越短,c、b、a的温度依次降低,所以达到平衡消耗时间关系为a>b>c,故C正确;该反应为可逆反应,反应的转化率不可能达到100%,故D错误。
11.科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,$N_{2}$在催化剂(掺有少量$Fe_{2}O_{3}$的$TiO_{2}$)表面与水发生反应,生成的主要产物为$NH_{3}$。进一步研究$NH_{3}$生成量与温度的关系,部分实验数据见下表(光照、$N_{2}$压强$1.0\times 10^{5}\ Pa$、反应时间$3\ h$):

相应的热化学方程式如下:
$N_{2}(g)+3H_{2}O(l)\rightleftharpoons 2NH_{3}(g)+\frac{3}{2}O_{2}(g)$ $\Delta H=+765.2\ kJ\cdot mol^{-1}$
回答下列问题:
(1)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大$NH_{3}$生成量的建议: 。
(2)工业合成氨的反应为$N_{2}(g)+3H_{2}(g)\underset{催化剂}{\overset{高温、高压}{\rightleftharpoons }}2NH_{3}(g)$。设在容积为$2.0\ L$的密闭容器中充入$0.60\ mol\ N_{2}(g)$和$1.60\ mol\ H_{2}(g)$,反应在一定条件下达到平衡时,$NH_{3}$的物质的量分数($NH_{3}$的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$。计算:
①该条件下$N_{2}$的平衡转化率为 。
②该条件下反应$2NH_{3}(g)\underset{催化剂}{\overset{高温、高压}{\rightleftharpoons }}N_{2}(g)+3H_{2}(g)$的平衡常数为 。
③根据合成氨反应的特点分析,当前最有前途的研究发展方向是 (填字母)。
a.研制耐高压的合成塔
b.采用超大规模的工业生产
c.研制耐低温复合催化剂
d.探索不用$H_{2}$和$N_{2}$合成氨的新途径

相应的热化学方程式如下:
$N_{2}(g)+3H_{2}O(l)\rightleftharpoons 2NH_{3}(g)+\frac{3}{2}O_{2}(g)$ $\Delta H=+765.2\ kJ\cdot mol^{-1}$
回答下列问题:
(1)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大$NH_{3}$生成量的建议: 。
(2)工业合成氨的反应为$N_{2}(g)+3H_{2}(g)\underset{催化剂}{\overset{高温、高压}{\rightleftharpoons }}2NH_{3}(g)$。设在容积为$2.0\ L$的密闭容器中充入$0.60\ mol\ N_{2}(g)$和$1.60\ mol\ H_{2}(g)$,反应在一定条件下达到平衡时,$NH_{3}$的物质的量分数($NH_{3}$的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$。计算:
①该条件下$N_{2}$的平衡转化率为 。
②该条件下反应$2NH_{3}(g)\underset{催化剂}{\overset{高温、高压}{\rightleftharpoons }}N_{2}(g)+3H_{2}(g)$的平衡常数为 。
③根据合成氨反应的特点分析,当前最有前途的研究发展方向是 (填字母)。
a.研制耐高压的合成塔
b.采用超大规模的工业生产
c.研制耐低温复合催化剂
d.探索不用$H_{2}$和$N_{2}$合成氨的新途径
答案:
解析:
(2)①设反应过程消耗x mol N₂(g)。
N₂(g) + 3H₂(g)$\underset{催化剂}{\overset{高温、高压}{⇌}}$2NH₃(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60 - x 1.60 - 3x 2x
平衡时反应体系总物质的量 = [(0.60 - x)+(1.60 - 3x)+2x]mol=(2.20 - 2x)mol
NH₃(g)的物质的量分数为$\frac{2x}{2.20 - 2x}=\frac{4}{7}$
解得,x = 0.40,N₂的平衡转化率为$\frac{0.40 mol}{0.60 mol}\times100\%\approx66.7\%$。
②设此时反应2NH₃(g)⇌N₂(g)+3H₂(g)的平衡常数为K。平衡时,c(NH₃)=$\frac{2×0.40}{2.0}mol\cdot L^{-1}=0.40 mol\cdot L^{-1}$,c(N₂)=$\frac{0.60 - 0.40}{2.0}mol\cdot L^{-1}=0.10 mol\cdot L^{-1}$,c(H₂)=$\frac{1.60 - 3×0.40}{2.0}mol\cdot L^{-1}=0.20 mol\cdot L^{-1}$,K = $\frac{c(N₂)\cdot c^{3}(H₂)}{c^{2}(NH₃)}=5.0×10^{-3}$。
答案:
(1)升温、增大N₂浓度(合理即可)
(2)①66.7% ②5.0×10⁻³ ③c
(2)①设反应过程消耗x mol N₂(g)。
N₂(g) + 3H₂(g)$\underset{催化剂}{\overset{高温、高压}{⇌}}$2NH₃(g)
起始物质的量/mol 0.60 1.60 0
平衡物质的量/mol 0.60 - x 1.60 - 3x 2x
平衡时反应体系总物质的量 = [(0.60 - x)+(1.60 - 3x)+2x]mol=(2.20 - 2x)mol
NH₃(g)的物质的量分数为$\frac{2x}{2.20 - 2x}=\frac{4}{7}$
解得,x = 0.40,N₂的平衡转化率为$\frac{0.40 mol}{0.60 mol}\times100\%\approx66.7\%$。
②设此时反应2NH₃(g)⇌N₂(g)+3H₂(g)的平衡常数为K。平衡时,c(NH₃)=$\frac{2×0.40}{2.0}mol\cdot L^{-1}=0.40 mol\cdot L^{-1}$,c(N₂)=$\frac{0.60 - 0.40}{2.0}mol\cdot L^{-1}=0.10 mol\cdot L^{-1}$,c(H₂)=$\frac{1.60 - 3×0.40}{2.0}mol\cdot L^{-1}=0.20 mol\cdot L^{-1}$,K = $\frac{c(N₂)\cdot c^{3}(H₂)}{c^{2}(NH₃)}=5.0×10^{-3}$。
答案:
(1)升温、增大N₂浓度(合理即可)
(2)①66.7% ②5.0×10⁻³ ③c
查看更多完整答案,请扫码查看


