2025年与名师对话高中新教材同步导练案化学C选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年与名师对话高中新教材同步导练案化学C选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
13.已知:①H₂S是二元弱酸;②CuSO₄ + H₂S ══ CuS↓ + H₂SO₄。向H₂S溶液中通入或加入少量的以下物质:①Cl₂;②SO₂;③CuSO₄。其中能使溶液中c(H⁺)增大的是( )
A.①② B.①③ C.②③ D.①②③
A.①② B.①③ C.②③ D.①②③
答案:
B H₂S溶液中存在平衡:H₂S⇌H⁺ + HS⁻,HS⁻⇌H⁺ + S²⁻。向其中加入少量的CuSO₄时,Cu²⁺会与S²⁻结合生成CuS沉淀,c(S²⁻)减小,平衡向右移动,溶液中c(H⁺)增大;SO₂能与H₂S反应生成S和H₂O,平衡向左移动,c(H⁺)减小;Cl₂与H₂S反应生成S和HCl,HCl是强酸,溶液中c(H⁺)增大。综上所述,B项正确。
14.由表中的电离平衡常数判断可以发生的反应是( )

A.NaBrO + NaHCO₃ ══ HBrO + Na₂CO₃
B.2HBrO + Na₂CO₃ ══ 2NaBrO + H₂O + CO₂↑
C.HBrO + NaHCO₃ ══ NaBrO + H₂O + CO₂↑
D.NaBrO + CO₂ + H₂O ══ NaHCO₃ + HBrO

A.NaBrO + NaHCO₃ ══ HBrO + Na₂CO₃
B.2HBrO + Na₂CO₃ ══ 2NaBrO + H₂O + CO₂↑
C.HBrO + NaHCO₃ ══ NaBrO + H₂O + CO₂↑
D.NaBrO + CO₂ + H₂O ══ NaHCO₃ + HBrO
答案:
D 相同温度下,酸的电离平衡常数越大,酸的酸性越强,根据表中数据知,酸性强弱顺序是H₂CO₃>HBrO>HCO₃⁻。根据“强酸可以制弱酸”进行判断。A选项,HBrO的酸性大于HCO₃⁻,所以HBrO + Na₂CO₃ = NaBrO + NaHCO₃能发生,故A错误;B选项,酸性:H₂CO₃>HBrO,所以碳酸钠和次溴酸反应不能生成二氧化碳,故B错误;C选项,酸性:H₂CO₃>HBrO,所以次溴酸和碳酸氢钠不反应,故C错误;D选项,酸性:H₂CO₃>HBrO>HCO₃⁻,所以碳酸能和次溴酸钠反应生成碳酸氢钠和次溴酸,故D正确。
15.甲酸的下列性质中,可以证明它是弱电解质的是( )
A.甲酸以任意比与水互溶
B.0.1 mol/L甲酸溶液的c(H⁺)=10⁻³ mol/L
C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比一元强酸溶液的弱
A.甲酸以任意比与水互溶
B.0.1 mol/L甲酸溶液的c(H⁺)=10⁻³ mol/L
C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比一元强酸溶液的弱
答案:
B 溶解性与电解质强弱无关,故A错误;甲酸是一元酸,酸的浓度大于H⁺的浓度,说明甲酸不能完全电离,应属于弱电解质,故B正确;10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液反应,只能说明甲酸是一元酸,不能证明甲酸是弱酸,故C错误;在浓度相同时,比较甲酸与一元强酸溶液的导电性,若甲酸溶液的导电性弱,才可判断其为弱电解质,溶液中离子浓度小,溶液导电性会弱于强电解质,故D错误。
16.2019年11月8日,据欧盟官方公报消息,欧盟委员会发布条例,修订芥酸和氢氰酸在部分食品中的最大含量。氢氰酸及部分弱酸的电离常数如下表:
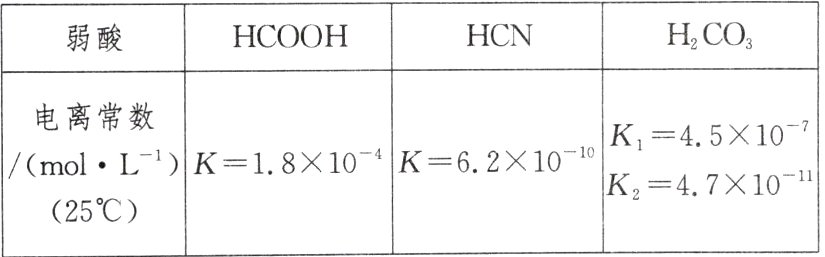
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为____________________。
(2)向NaCN溶液中通入CO₂气体能否制得HCN?______。若能写出反应的化学方程式____________________。
(3)同浓度的HCOO⁻、HCO₃⁻、CO₃²⁻、CN⁻结合H⁺的能力由强到弱的顺序是____________________。
(4)①升高0.1 mol·L⁻¹ HCN溶液的温度,HCN的电离程度如何变化?____________________。
②加水稀释,$\frac{c(H^{+})}{c(HCN)}$如何变化?____________________。

(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为____________________。
(2)向NaCN溶液中通入CO₂气体能否制得HCN?______。若能写出反应的化学方程式____________________。
(3)同浓度的HCOO⁻、HCO₃⁻、CO₃²⁻、CN⁻结合H⁺的能力由强到弱的顺序是____________________。
(4)①升高0.1 mol·L⁻¹ HCN溶液的温度,HCN的电离程度如何变化?____________________。
②加水稀释,$\frac{c(H^{+})}{c(HCN)}$如何变化?____________________。
答案:
(1)HCOOH>H₂CO₃>HCN
(2)能 NaCN + H₂O + CO₂ = HCN + NaHCO₃
(3)CO₃²⁻>CN⁻>HCO₃⁻>HCOO⁻
(4)①升高温度,能促进HCN的电离
②加水稀释,$\frac{c(H⁺)}{c(HCN)}$增大
(1)HCOOH>H₂CO₃>HCN
(2)能 NaCN + H₂O + CO₂ = HCN + NaHCO₃
(3)CO₃²⁻>CN⁻>HCO₃⁻>HCOO⁻
(4)①升高温度,能促进HCN的电离
②加水稀释,$\frac{c(H⁺)}{c(HCN)}$增大
17.(1)某浓度的氨水中存在平衡:NH₃·H₂O⇌NH₄⁺ + OH⁻。如想增大NH₄⁺的浓度而不增大OH⁻的浓度,应采取的措施是__________(填字母)。
a.适当升高温度 b.加入NH₄Cl固体 c.通入NH₃ d.加入少量浓盐酸
(2)常温下,有c(H⁺)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H⁺)变化是醋酸溶液中c(H⁺)__________(填“增大”“减小”或“不变”,下同),盐酸中c(H⁺)__________。
②加水稀释10倍后,醋酸溶液中的c(H⁺)__________(填“>”“ = ”或“<”,下同)盐酸中的c(H⁺)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸__________盐酸。
④使温度都升高20℃,溶液中c(H⁺):醋酸__________盐酸。
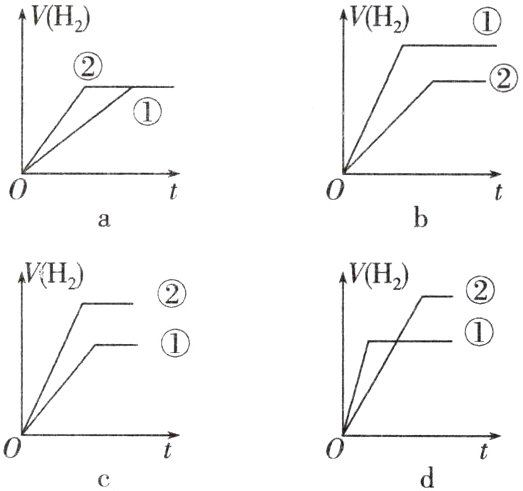
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是__________(填字母)。(①表示盐酸,②表示醋酸)
(3)将0.1 mol·L⁻¹ 的CH₃COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是__________(填字母)。
a.电离程度增大 b.溶液中离子总数增多 c.溶液导电性增强 d.溶液中醋酸分子增多
a.适当升高温度 b.加入NH₄Cl固体 c.通入NH₃ d.加入少量浓盐酸
(2)常温下,有c(H⁺)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H⁺)变化是醋酸溶液中c(H⁺)__________(填“增大”“减小”或“不变”,下同),盐酸中c(H⁺)__________。
②加水稀释10倍后,醋酸溶液中的c(H⁺)__________(填“>”“ = ”或“<”,下同)盐酸中的c(H⁺)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸__________盐酸。
④使温度都升高20℃,溶液中c(H⁺):醋酸__________盐酸。
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是__________(填字母)。(①表示盐酸,②表示醋酸)

(3)将0.1 mol·L⁻¹ 的CH₃COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是__________(填字母)。
a.电离程度增大 b.溶液中离子总数增多 c.溶液导电性增强 d.溶液中醋酸分子增多
答案:
(1)bd
(2)①减小 减小 ②> ③> ④> ⑤c
(3)ab
(1)bd
(2)①减小 减小 ②> ③> ④> ⑤c
(3)ab
查看更多完整答案,请扫码查看


