2025年5年高考3年模拟高中化学全一册人教B版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学全一册人教B版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
1.(2024湖北十一校二模,9,改编)实验室用MnO₂等原料制取少量KMnO₄的实验流程如下。下列说法错误的是 ( )
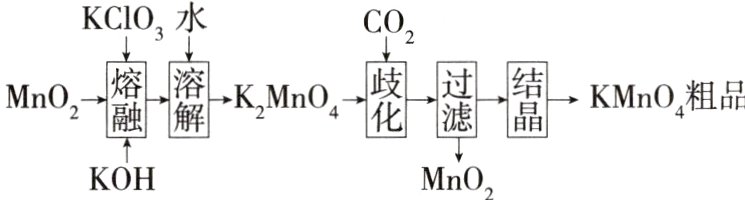
A.通入CO₂“歧化”时,氧化剂与还原剂的物质的量之比为1∶2
B.可循环利用的物质是MnO₂
C.“过滤”时,为加快分离速率可采用减压过滤
D.向粗品中滴加盐酸若产生气泡则说明含有K₂CO₃

A.通入CO₂“歧化”时,氧化剂与还原剂的物质的量之比为1∶2
B.可循环利用的物质是MnO₂
C.“过滤”时,为加快分离速率可采用减压过滤
D.向粗品中滴加盐酸若产生气泡则说明含有K₂CO₃
答案:
1 D 观察流程可知制取原理为MnO₂被氧化为K₂MnO₄[熔融过程中被氧化],K₂MnO₄发生歧化反应生成MnO₂、KMnO₄,歧化时反应为3K₂MnO₄ + 2CO₂ = MnO₂↓ + 2KMnO₄ + 2K₂CO₃,氧化剂与还原剂的物质的量之比为1∶2,A项正确;以MnO₂为原料,歧化时又生成了MnO₂,则MnO₂可循环利用,B项正确;“过滤”时,为加快分离速率可采用减压过滤,C项正确;根据A中反应,可知制得的KMnO₄粗品中可能会含有K₂CO₃,但若滴加盐酸,因Cl⁻具有还原性,酸性条件下,KMnO₄可将其氧化生成Cl₂,也有气泡产生,D项错误。
2.(2024九省联考贵州卷,11)高铁酸钠(Na₂FeO₄)是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为Fe,杂质有Al、C及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是 ( )
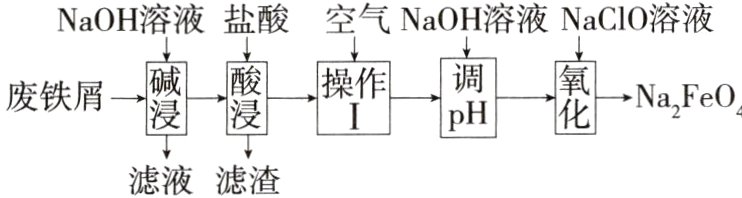
A.“碱浸”可以除去废铁屑中的油脂
B.“滤渣"的主要成分是Al和C
C.“操作I”通入的空气可以用H₂O₂溶液代替
D.若流程改为先“氧化”后“调pH”,可能会生成Cl₂

A.“碱浸”可以除去废铁屑中的油脂
B.“滤渣"的主要成分是Al和C
C.“操作I”通入的空气可以用H₂O₂溶液代替
D.若流程改为先“氧化”后“调pH”,可能会生成Cl₂
答案:
2 B 要制备高铁酸钠,则需除去废铁屑中的杂质Al、C及油脂。第一步,加NaOH溶液碱浸,Al和油脂被除去(留在滤液中)。第二步,加入盐酸酸浸,Fe反应生成FeCl₂,C留在滤渣中。第三步,通入空气将Fe²⁺氧化为Fe³⁺。第四步,加NaOH溶液调pH将Fe³⁺转化为Fe(OH)₃。第五步,Fe(OH)₃被NaClO氧化为Na₂FeO₄。综上分析可知A项正确、B项错误。第三步通入空气是为了氧化Fe²⁺,H₂O₂溶液可以达到相同的效果,C项正确。如果先氧化,在酸性环境中,Cl⁻和ClO⁻反应生成Cl₂,D项正确。
3.(2024福建泉州一模,9)SrCl₂是一种治疗牙本质过敏症的牙膏添加剂。一种用工业碳酸锶(含少量BaCO₃、FeO杂质)制取氯化锶晶体(SrCl₂·6H₂O)的工业流程如下。

下列说法错误的是 ( )
A.$K_{sp}(SrSO_4)>K_{sp}(BaSO_4)$
B.溶液Ⅰ中发生了反应2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O
C.工业碳酸锶的纯度为$\frac{148b}{267a}×100\%$
D.系列操作包括蒸发浓缩、冷却结晶等

下列说法错误的是 ( )
A.$K_{sp}(SrSO_4)>K_{sp}(BaSO_4)$
B.溶液Ⅰ中发生了反应2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O
C.工业碳酸锶的纯度为$\frac{148b}{267a}×100\%$
D.系列操作包括蒸发浓缩、冷却结晶等
答案:
3 C 要得到SrCl₂·6H₂O,则要除去BaCO₃和FeO,且中间过程中Sr不能损失。观察流程,第一步加入盐酸,则SrCO₃、BaCO₃和FeO全部溶解,生成相应的金属阳离子进入溶液Ⅰ。第二步,加入适量硫酸[生成BaSO₄(滤渣1)],除去Ba²⁺;加入H₂O₂将Fe²⁺氧化为Fe³⁺。第三步,加入SrCO₃调节溶液的pH,将Fe³⁺转化为Fe(OH)₃[滤渣2],得到含SrCl₂的滤液。由以上分析可知,在第二步加入硫酸的过程中要求Ba²⁺沉淀,而Sr²⁺不沉淀,说明Kₛₚ(SrSO₄)>Kₛₚ(BaSO₄),A项正确;溶液Ⅰ中发生反应2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O,B项正确;因在第三步中向溶液Ⅱ中加入了SrCO₃,则工业碳酸锶的纯度应小于$\frac{148b}{267a}\times100\%$,C项错误;系列操作是从溶液Ⅲ中得到SrCl₂·6H₂O,故包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,D项正确。
4.(2024江西鹰潭一模,12)利用含钴废料(主要成分为Co₃O₄,还含有少量的铝箔、LiCoO₂等杂质)制备碳酸钴的工艺流程如图:
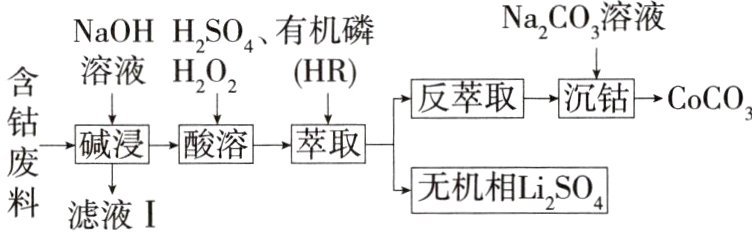
已知:萃取Co²⁺的原理为Co²⁺ + 2HR ⇌ CoR₂ + 2H⁺。
下列说法错误的是 ( )
A.“滤液I”中溶质的主要成分是Na[Al(OH)₄]
B.“酸溶"反应中H₂O₂作氧化剂
C.“反萃取”中可加入H₂SO₄分离出Co²⁺
D.“沉钴”时Na₂CO₃溶液滴加速率不宜过快,目的是防止生成Co(OH)₂

已知:萃取Co²⁺的原理为Co²⁺ + 2HR ⇌ CoR₂ + 2H⁺。
下列说法错误的是 ( )
A.“滤液I”中溶质的主要成分是Na[Al(OH)₄]
B.“酸溶"反应中H₂O₂作氧化剂
C.“反萃取”中可加入H₂SO₄分离出Co²⁺
D.“沉钴”时Na₂CO₃溶液滴加速率不宜过快,目的是防止生成Co(OH)₂
答案:
4 B 原料中Co主要以Co₃O₄形式存在,要制得CoCO₃,需要除去铝箔、Li元素等杂质,还需要将Co₃O₄还原为Co²⁺。第一步,加入NaOH溶液,铝箔溶解,以Na[Al(OH)₄]的形式进入滤液Ⅰ。第二步加入H₂SO₄和H₂O₂,分析整个流程加入的试剂,可知Co₃O₄在此时被还原为Co²⁺[H₂O₂作还原剂]。第三步加入HR萃取剂得到了无机相Li₂SO₄[说明LiCoO₂在第一步操作后,与Co₃O₄一起进入第二步酸溶环节],则Co²⁺在有机相。第四步,反萃取过程是让Co²⁺从有机相重新进入水相;根据题给萃取原理,可知加入H₂SO₄后,H⁺浓度增大,使萃取平衡逆向移动,Co²⁺进入水相。第五步,沉钴,发生反应Co²⁺ + CO₃²⁻ = CoCO₃↓,如果Na₂CO₃的滴速过快,溶液碱性增强,可能生成Co(OH)₂杂质;综上可知选B。
易错警示
不要一看到H₂O₂就觉得是起氧化作用,要看题中的具体情境。
易错警示
不要一看到H₂O₂就觉得是起氧化作用,要看题中的具体情境。
5.(2024安徽皖南八校三联,13)生产镍蓄电池的材料之一为三氧化二镍(Ni₂O₃),一种从含镍废料(主要成分为镍、铝、氧化铁、碳等)获得Ni₂O₃的工业流程如图所示:
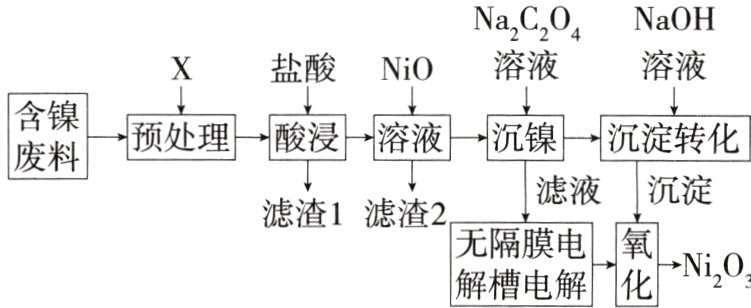
已知:①NiCl₂易溶于水,Fe³⁺不能氧化Ni²⁺;②$K_{sp}[Fe(OH)_3]=8.0×10^{-38}$;③当溶液中离子浓度≤1×10⁻⁵ mol·L⁻¹时,认为沉淀完全;④lg 2 = 0.3。
下列说法错误的是 ( )
A.为除去含镍废料表面的矿物油,X可选用乙醇
B.“酸浸”后的溶液中含有Fe³⁺、Ni²⁺、Al³⁺,可以用KSCN溶液证明Fe³⁺不能氧化Ni²⁺
C.常温下,加NiO调节溶液pH = 3.3时,溶液中Fe³⁺刚好沉淀完全
D.“无隔膜电解槽电解”发生的总反应为NaCl + H₂O$\stackrel{电解}{=\!=\!=}$NaClO + H₂↑

已知:①NiCl₂易溶于水,Fe³⁺不能氧化Ni²⁺;②$K_{sp}[Fe(OH)_3]=8.0×10^{-38}$;③当溶液中离子浓度≤1×10⁻⁵ mol·L⁻¹时,认为沉淀完全;④lg 2 = 0.3。
下列说法错误的是 ( )
A.为除去含镍废料表面的矿物油,X可选用乙醇
B.“酸浸”后的溶液中含有Fe³⁺、Ni²⁺、Al³⁺,可以用KSCN溶液证明Fe³⁺不能氧化Ni²⁺
C.常温下,加NiO调节溶液pH = 3.3时,溶液中Fe³⁺刚好沉淀完全
D.“无隔膜电解槽电解”发生的总反应为NaCl + H₂O$\stackrel{电解}{=\!=\!=}$NaClO + H₂↑
答案:
5 B 矿物油的主要成分是烃类,则可用乙醇来清除,A项正确;用KSCN溶液只能说明溶液中有Fe³⁺,但不能说明Fe³⁺没有氧化Ni²⁺,如要证明,则需要证明溶液中不存在Fe²⁺,可用K₃[Fe(CN)₆]溶液,B项错误;Kₛₚ[Fe(OH)₃]=8.0×10⁻³⁸ = c(Fe³⁺)×c³(OH⁻) = 10⁻⁵×c³(OH⁻),得c(OH⁻)=2×10⁻¹¹ mol·L⁻¹,pOH = -lgc(OH⁻) = -lg(2×10⁻¹¹)=10.7,则pH=3.3,C项正确;沉镍后的滤液为NaCl溶液,电解NaCl溶液得到NaOH、Cl₂、H₂,采用无隔膜电解槽电解时,生成的NaOH、Cl₂发生反应得到NaClO、NaCl和H₂O,总反应为NaCl + H₂O $\stackrel{电解}{=\!=\!=}$ NaClO + H₂↑,D项正确。
6.(2024重庆九龙坡二模,15)氧化钪(Sc₂O₃)可用作半导体镀层的蒸镀材料。可从金属提取工艺中的固体废料“赤泥”(含有Fe₂O₃、SiO₂、Sc₂O₃、TiO₂等)里回收Sc₂O₃。请结合流程,回答以下问题:
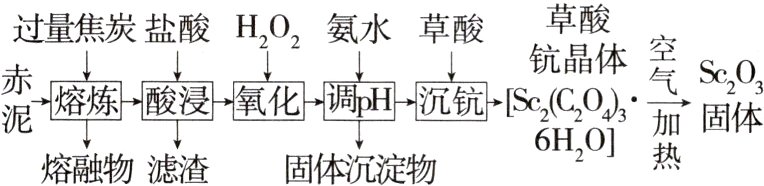
已知:①Sc₂O₃和TiO₂性质较稳定,不易被还原,且TiO₂难溶于盐酸;
②“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来;
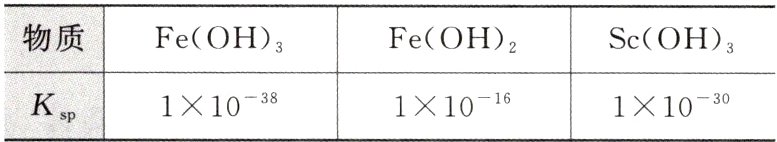
③草酸可与多种金属离子形成可溶性络合物;④常温下,部分氢氧化物的溶度积常数如下表所示:
(1)元素Sc在元素周期表中位于______区。
(2)“熔炼”时,请写出生成Fe的反应的化学方程式:________________________。
(3)“酸浸”时,滤渣的主要成分为______(填化学式)。
(4)“氧化”时,加入H₂O₂的目的是________________________(用离子方程式表示)。
(5)常温下,“调pH”时,溶液中c(Sc³⁺) = 0.001 mol·L⁻¹,为除去杂质离子,应控制的pH范围是______;为检验该杂质离子是否除尽,可选用______(填化学式)溶液进行检验。(当溶液中某离子浓度c≤1.0×10⁻⁵ mol·L⁻¹时,可认为该离子沉淀完全)
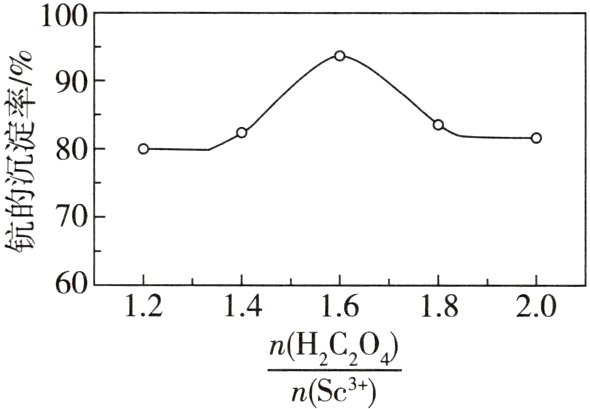
(6)反应过程中,测得钪的沉淀率随$\frac{n(H_2C_2O_4)}{n(Sc^{3+})}$的变化情况如图所示。当草酸用量过多时,钪的沉淀率下降的原因是________________________。
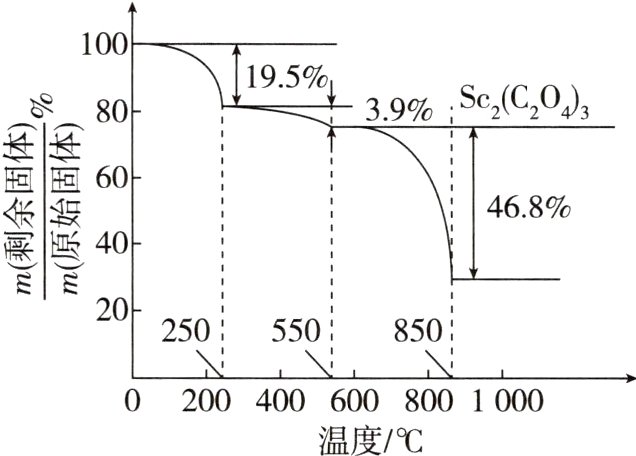
(7)草酸钪晶体[Sc₂(C₂O₄)₃·6H₂O]在空气中加热,$\frac{m(剩余固体)}{m(原始固体)}$随温度的变化情况如图所示。250 ℃时,晶体的主要成分是______(填化学式){M[Sc₂(C₂O₄)₃·6H₂O] = 462 g·mol⁻¹}。

已知:①Sc₂O₃和TiO₂性质较稳定,不易被还原,且TiO₂难溶于盐酸;
②“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来;
③草酸可与多种金属离子形成可溶性络合物;④常温下,部分氢氧化物的溶度积常数如下表所示:

(1)元素Sc在元素周期表中位于______区。
(2)“熔炼”时,请写出生成Fe的反应的化学方程式:________________________。
(3)“酸浸”时,滤渣的主要成分为______(填化学式)。
(4)“氧化”时,加入H₂O₂的目的是________________________(用离子方程式表示)。
(5)常温下,“调pH”时,溶液中c(Sc³⁺) = 0.001 mol·L⁻¹,为除去杂质离子,应控制的pH范围是______;为检验该杂质离子是否除尽,可选用______(填化学式)溶液进行检验。(当溶液中某离子浓度c≤1.0×10⁻⁵ mol·L⁻¹时,可认为该离子沉淀完全)
(6)反应过程中,测得钪的沉淀率随$\frac{n(H_2C_2O_4)}{n(Sc^{3+})}$的变化情况如图所示。当草酸用量过多时,钪的沉淀率下降的原因是________________________。

(7)草酸钪晶体[Sc₂(C₂O₄)₃·6H₂O]在空气中加热,$\frac{m(剩余固体)}{m(原始固体)}$随温度的变化情况如图所示。250 ℃时,晶体的主要成分是______(填化学式){M[Sc₂(C₂O₄)₃·6H₂O] = 462 g·mol⁻¹}。

答案:
答案 (1)d (2)Fe₂O₃ + 3C $\stackrel{高温}{=\!=\!=}$ 2Fe + 3CO↑ (3)TiO₂、C (4)H₂O₂ + 2Fe²⁺ + 2H⁺ = 2Fe³⁺ + 2H₂O (5)3≤pH<5 KSCN (6)草酸用量过多时,草酸钪沉淀会转化为可溶性络合物,使钪的沉淀率下降 (7)Sc₂(C₂O₄)₃·H₂O
解析 由流程图并结合已知信息知,“熔炼”时大部分单质Fe和Si转化为熔融物分离出来,Sc₂O₃、TiO₂性质较稳定,不易被还原。加入盐酸后将Fe转化为Fe²⁺,Sc₂O₃转化为Sc³⁺,TiO₂难溶于盐酸,故滤渣的主要成分为TiO₂和过量的C。向滤液中加入H₂O₂将Fe²⁺氧化为Fe³⁺便于后续调节pH将Fe³⁺除去,则固体沉淀物为Fe(OH)₃。向滤液中加入草酸,得到Sc₂(C₂O₄)₃·6H₂O,过滤、洗涤、干燥后,在空气中加热得到Sc₂O₃固体。
(1)Sc元素位于周期表第四周期第ⅢB族,属于d区元素。
(2)“熔炼”时,焦炭将Fe₂O₃还原为Fe,焦炭过量,生成CO。
(5)常温下,“调pH”,使Fe³⁺完全沉淀,c(OH⁻)≥$\sqrt[3]{\frac{1×10^{-38}}{1×10^{-5}}}$ mol·L⁻¹=1×10⁻¹¹ mol·L⁻¹,即pH≥3;溶液中c(Sc³⁺)=0.001 mol·L⁻¹,Sc³⁺不沉淀,则c(OH⁻)<$\sqrt[3]{\frac{1×10^{-30}}{0.001}}$ mol·L⁻¹=1×10⁻⁹ mol·L⁻¹,即pH<5,故应控制的pH范围是3≤pH<5;杂质离子为Fe³⁺,可用KSCN溶液检验是否除尽。(6)由已知信息③知,草酸可与多种金属离子形成可溶性络合物,则草酸用量过多时,草酸钪沉淀会转化为可溶性络合物,使钪的沉淀率下降。(7)Sc₂(C₂O₄)₃·6H₂O的摩尔质量为462 g·mol⁻¹,设Sc₂(C₂O₄)₃·6H₂O的初始质量为462 g,即1 mol。加热时,先失去结晶水,由图知,250 ℃时,减少的质量为462 g×19.5%≈90.1 g,则1 mol Sc₂(C₂O₄)₃·6H₂O失去结晶水的物质的量为$\frac{90 g}{18 g·mol^{-1}}$=5 mol,故此时晶体的主要成分是Sc₂(C₂O₄)₃·H₂O。
解析 由流程图并结合已知信息知,“熔炼”时大部分单质Fe和Si转化为熔融物分离出来,Sc₂O₃、TiO₂性质较稳定,不易被还原。加入盐酸后将Fe转化为Fe²⁺,Sc₂O₃转化为Sc³⁺,TiO₂难溶于盐酸,故滤渣的主要成分为TiO₂和过量的C。向滤液中加入H₂O₂将Fe²⁺氧化为Fe³⁺便于后续调节pH将Fe³⁺除去,则固体沉淀物为Fe(OH)₃。向滤液中加入草酸,得到Sc₂(C₂O₄)₃·6H₂O,过滤、洗涤、干燥后,在空气中加热得到Sc₂O₃固体。
(1)Sc元素位于周期表第四周期第ⅢB族,属于d区元素。
(2)“熔炼”时,焦炭将Fe₂O₃还原为Fe,焦炭过量,生成CO。
(5)常温下,“调pH”,使Fe³⁺完全沉淀,c(OH⁻)≥$\sqrt[3]{\frac{1×10^{-38}}{1×10^{-5}}}$ mol·L⁻¹=1×10⁻¹¹ mol·L⁻¹,即pH≥3;溶液中c(Sc³⁺)=0.001 mol·L⁻¹,Sc³⁺不沉淀,则c(OH⁻)<$\sqrt[3]{\frac{1×10^{-30}}{0.001}}$ mol·L⁻¹=1×10⁻⁹ mol·L⁻¹,即pH<5,故应控制的pH范围是3≤pH<5;杂质离子为Fe³⁺,可用KSCN溶液检验是否除尽。(6)由已知信息③知,草酸可与多种金属离子形成可溶性络合物,则草酸用量过多时,草酸钪沉淀会转化为可溶性络合物,使钪的沉淀率下降。(7)Sc₂(C₂O₄)₃·6H₂O的摩尔质量为462 g·mol⁻¹,设Sc₂(C₂O₄)₃·6H₂O的初始质量为462 g,即1 mol。加热时,先失去结晶水,由图知,250 ℃时,减少的质量为462 g×19.5%≈90.1 g,则1 mol Sc₂(C₂O₄)₃·6H₂O失去结晶水的物质的量为$\frac{90 g}{18 g·mol^{-1}}$=5 mol,故此时晶体的主要成分是Sc₂(C₂O₄)₃·H₂O。
查看更多完整答案,请扫码查看


