2025年5年高考3年模拟高中化学全一册人教B版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学全一册人教B版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第148页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
15.(2021辽宁,15,3分)用0.100 0 mol·L⁻¹盐酸滴定20.00 mL Na₂A溶液,溶液中H₂A、HA⁻、A²⁻的分布分数δ随pH变化曲线及滴定曲线如图。[如A²⁻分布分数:δ(A²⁻)=$\frac{c(A²⁻)}{c(H₂A)+c(HA⁻)+c(A²⁻)}$]
下列说法正确的是 ( )
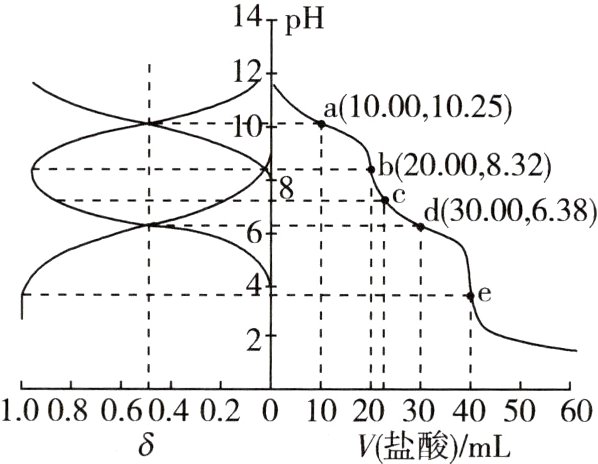
A.H₂A的Kₐ₂为10⁻¹⁰.²⁵
B.c点:c(HA⁻)>c(A²⁻)>c(H₂A)
C.第一次突变,可选用酚酞作指示剂
D.c(Na₂A)=0.200 0 mol·L⁻¹
下列说法正确的是 ( )

A.H₂A的Kₐ₂为10⁻¹⁰.²⁵
B.c点:c(HA⁻)>c(A²⁻)>c(H₂A)
C.第一次突变,可选用酚酞作指示剂
D.c(Na₂A)=0.200 0 mol·L⁻¹
答案:
C A项,H₂A的Kₐ₁=c(H⁺)·c(HA⁻)/c(H₂A),根据题图可知,当c(HA⁻)=c(H₂A)时,pH=6.38,则Kₐ₁=10⁻⁶.³⁸,错误;B项,根据题图可知,c点时c(HA⁻)>c(H₂A)>c(A²⁻),错误;C项,根据题图可知,第一次突变时溶液呈碱性,故可以选择酚酞作指示剂,正确;D项,根据题图可知e点时达到滴定终点,此时加入盐酸40 mL,根据Na₂A+2HCl=2NaCl+H₂A计算可知c(Na₂A)=0.100 0 mol·L⁻¹,错误。
审题指导
用0.100 0 mol·L⁻¹盐酸滴定20.00 mL Na₂A溶液,随着pH的减小,A²⁻的分布分数逐渐减小,HA⁻的分布分数先逐渐增大后逐渐减小,H₂A的分布分数逐渐增大。
审题指导
用0.100 0 mol·L⁻¹盐酸滴定20.00 mL Na₂A溶液,随着pH的减小,A²⁻的分布分数逐渐减小,HA⁻的分布分数先逐渐增大后逐渐减小,H₂A的分布分数逐渐增大。
16.(2021湖南,9,3分)常温下,用0.100 0 mol·L⁻¹的盐酸分别滴定20.00 mL浓度均为0.100 0 mol·L⁻¹的三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。下列判断错误的是 ( )
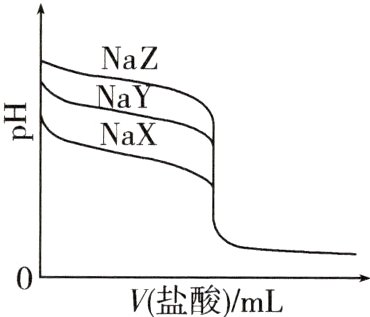
A.该NaX溶液中:c(Na⁺)>c(X⁻)>c(OH⁻)>c(H⁺)
B.三种一元弱酸的电离常数:Kₐ(HX)>Kₐ(HY)>Kₐ(HZ)
C.当pH = 7时,三种溶液中:c(X⁻)=c(Y⁻)=c(Z⁻)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X⁻)+c(Y⁻)+c(Z⁻)=c(H⁺)-c(OH⁻)

A.该NaX溶液中:c(Na⁺)>c(X⁻)>c(OH⁻)>c(H⁺)
B.三种一元弱酸的电离常数:Kₐ(HX)>Kₐ(HY)>Kₐ(HZ)
C.当pH = 7时,三种溶液中:c(X⁻)=c(Y⁻)=c(Z⁻)
D.分别滴加20.00 mL盐酸后,再将三种溶液混合:c(X⁻)+c(Y⁻)+c(Z⁻)=c(H⁺)-c(OH⁻)
答案:
C A项,NaX溶液中存在NaX=Na⁺+X⁻,X⁻+H₂O⇌HX+OH⁻,溶液显碱性,所以c(Na⁺)>c(X⁻)>c(OH⁻)>c(H⁺),正确;B项,当V(盐酸)=0时,NaZ溶液的pH最大,说明Z⁻水解程度最大[越弱越水解],则对应的HZ酸性最弱,同理得HX酸性最强,正确;C项,pH=7时,根据电荷守恒(用A⁻表示X⁻、Y⁻、Z⁻),各溶液中均存在n(Na⁺)+n(H⁺)=n(A⁻)+n(Cl⁻)+n(OH⁻),则n(Na⁺)=n(A⁻)+n(Cl⁻),三种溶液中n(Na⁺)相同,所加入盐酸的量不同[NaZ中最多,NaX中最少],最终溶液体积为V(NaZ)>V(NaY)>V(NaX),NaZ溶液中n(Cl⁻)最大,NaX溶液中n(Cl⁻)最小,则pH=7时,三种溶液中n(A⁻)的大小:n(Z⁻)<n(Y⁻)<n(X⁻),根据c=n/V得,c(Z⁻)<c(Y⁻)<c(X⁻),错误;D项,分别滴加20.00 mL盐酸后,再将三种溶液混合,根据电荷守恒,得c(Na⁺)+c(H⁺)=c(X⁻)+c(Y⁻)+c(Z⁻)+c(Cl⁻)+c(OH⁻),由于c(Na⁺)=c(Cl⁻),所以c(X⁻)+c(Y⁻)+c(Z⁻)=c(H⁺)-c(OH⁻),正确。
名师点睛
图像题中的等效替换,对于B项分析NaX、NaY、NaZ三种溶液pH=7时,所加盐酸的体积,有的同学会费时,此时假设NaX为NaCl,NaY为CH₃COONa,可知pH=7时相当于向NaX中加水,向NaY中加入盐酸,则所加盐酸体积NaX<NaY,同理可知NaX<NaY<NaZ。
名师点睛
图像题中的等效替换,对于B项分析NaX、NaY、NaZ三种溶液pH=7时,所加盐酸的体积,有的同学会费时,此时假设NaX为NaCl,NaY为CH₃COONa,可知pH=7时相当于向NaX中加水,向NaY中加入盐酸,则所加盐酸体积NaX<NaY,同理可知NaX<NaY<NaZ。
17.(2020海南,12,4分)某弱酸HA溶液中主要成分的分布分数随pH的变化如图所示。下列说法错误的是 ( )
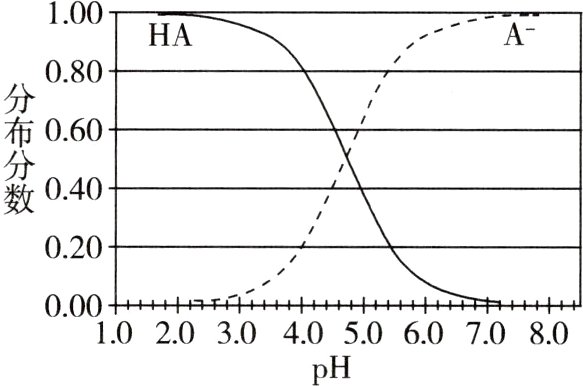
A.该酸 -lgKₐ≈4.7
B.NaA的水解平衡常数Kₕ=$\frac{1}{K_{a}}$
C.当该溶液的pH = 7.0时,c(HA)<c(A⁻)
D.某c(HA):c(A⁻)=4:1的缓冲溶液,pH≈4

A.该酸 -lgKₐ≈4.7
B.NaA的水解平衡常数Kₕ=$\frac{1}{K_{a}}$
C.当该溶液的pH = 7.0时,c(HA)<c(A⁻)
D.某c(HA):c(A⁻)=4:1的缓冲溶液,pH≈4
答案:
B [对于给出分布分数,求Kₐ或 -lgKₐ,一定要找到合适的交点]A项,图中交点处c(HA)=c(A⁻),Kₐ=c(H⁺)·c(A⁻)/c(HA)=c(H⁺)≈10⁻⁴.⁷,故 -lgKₐ≈4.7,正确;B项,NaA的水解平衡常数Kₕ=Kₙ/Kₐ,错误;C项,根据题给图像可知,当该溶液的pH=7.0时,c(HA)<c(A⁻),正确;D项,根据题给图像可知,当HA与A⁻的分布分数分别为0.8、0.2时,pH约为4,故某c(HA)∶c(A⁻)=4∶1的缓冲溶液,pH≈4,正确。
18.(2020天津,7,3分)常温下,下列有关电解质溶液的说法错误的是 ( )
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Kₐ(HCOOH)>Kₐ(HF)
B.相同浓度的CH₃COOH和CH₃COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH₃COO⁻)>c(Na⁺)>c(H⁺)>c(OH⁻)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Kₛₚ(FeS)>Kₛₚ(CuS)
D.在1 mol·L⁻¹ Na₂S溶液中,c(S²⁻)+c(HS⁻)+c(H₂S)=1 mol·L⁻¹
A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Kₐ(HCOOH)>Kₐ(HF)
B.相同浓度的CH₃COOH和CH₃COONa两溶液等体积混合后pH约为4.7,则溶液中c(CH₃COO⁻)>c(Na⁺)>c(H⁺)>c(OH⁻)
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Kₛₚ(FeS)>Kₛₚ(CuS)
D.在1 mol·L⁻¹ Na₂S溶液中,c(S²⁻)+c(HS⁻)+c(H₂S)=1 mol·L⁻¹
答案:
A A项,相同浓度的HCOONa溶液和NaF溶液,HCOONa溶液的pH较大说明HCOO⁻水解程度大于F⁻,依据“越弱越水解”,HCOOH的酸性弱于HF,即Kₐ(HCOOH)<Kₐ(HF),错误;B项,相同浓度的CH₃COOH溶液和CH₃COONa溶液等体积混合后pH约为4.7,说明CH₃COOH的电离程度大于CH₃COO⁻的水解程度,则溶液中c(CH₃COO⁻)>c(Na⁺)>c(H⁺)>c(OH⁻),正确;C项,加入稀硫酸后FeS中存在:FeS(s)⇌Fe²⁺(aq)+S²⁻(aq),CuS中存在:CuS(s)⇌Cu²⁺(aq)+S²⁻(aq),FeS溶解是由于H⁺与S²⁻结合形成H₂S,使沉淀溶解平衡正向移动,CuS不溶解说明溶液中c(S²⁻)小,即FeS的溶解度大于CuS,Kₛₚ(FeS)>Kₛₚ(CuS),正确;D项,在1 mol·L⁻¹ Na₂S溶液中,依据元素守恒知,c(S²⁻)+c(HS⁻)+c(H₂S)=1 mol·L⁻¹,正确。
查看更多完整答案,请扫码查看


