2025年5年高考3年模拟高中化学全一册人教B版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学全一册人教B版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第151页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
25.(2023新课标,13,6分)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag⁺ + NH₃⇌[Ag(NH₃)]⁺和NH₃ + [Ag(NH₃)]⁺⇌[Ag(NH₃)₂]⁺。lg[c(M)/(mol·L⁻¹)]与lg[c(NH₃)/(mol·L⁻¹)]的关系如下图所示{其中M代表Ag⁺、Cl⁻、[Ag(NH₃)]⁺或[Ag(NH₃)₂]⁺}。
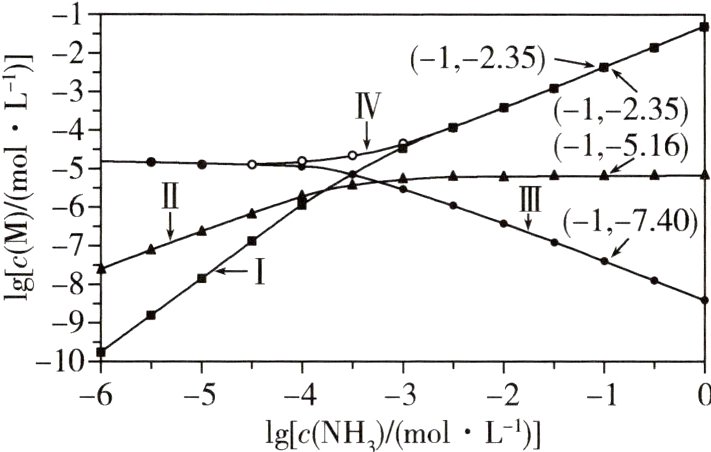
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH₃浓度变化曲线
B.AgCl的溶度积常数$K_{sp}=c(Ag⁺)·c(Cl⁻)=10⁻⁹.⁷⁵$
C.反应[Ag(NH₃)]⁺ + NH₃⇌[Ag(NH₃)₂]⁺的平衡常数K的值为10³.⁸¹
D.c(NH₃)=0.01mol·L⁻¹时,溶液中c{[Ag(NH₃)₂]⁺}>c{[Ag(NH₃)]⁺}>c(Ag⁺)

下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH₃浓度变化曲线
B.AgCl的溶度积常数$K_{sp}=c(Ag⁺)·c(Cl⁻)=10⁻⁹.⁷⁵$
C.反应[Ag(NH₃)]⁺ + NH₃⇌[Ag(NH₃)₂]⁺的平衡常数K的值为10³.⁸¹
D.c(NH₃)=0.01mol·L⁻¹时,溶液中c{[Ag(NH₃)₂]⁺}>c{[Ag(NH₃)]⁺}>c(Ag⁺)
答案:
25A AgCl饱和溶液中Ag⁺和Cl⁻浓度相等,随着氨水浓度增大,c(Ag⁺)变小,c(Cl⁻)增大,根据题图分析,曲线Ⅲ代表lgc(Ag⁺),曲线Ⅳ代表lgc(Cl⁻)。再根据题给两步反应分析,lgc{[Ag(NH₃)]⁺}先变大后减小(或不变),lgc{[Ag(NH₃)₂]⁺}逐渐增大,所以曲线Ⅰ代表lgc{[Ag(NH₃)₂]⁺},曲线Ⅱ代表lgc{[Ag(NH₃)]⁺}。A项,根据氯原子守恒,AgCl的溶解浓度与Cl⁻的浓度相等,故曲线Ⅳ可视为AgCl溶解度随NH₃浓度变化曲线,错误;B项,根据题图可知,lgc(NH₃)= - 1时,c(Ag⁺)=10⁻⁷.⁴⁰ mol·L⁻¹,c(Cl⁻)=10⁻².³⁵ mol·L⁻¹,AgCl的溶度积常数Kₛₚ=c(Ag⁺)·c(Cl⁻)=10⁻⁷.⁴⁰×10⁻².³⁵=10⁻⁹.⁷⁵,正确;C项,根据题图中lgc(NH₃)= - 1时的数据可知,反应[Ag(NH₃)]⁺ + NH₃⇌[Ag(NH₃)₂]⁺的平衡常数K = $\frac{c\{[Ag(NH_{3})_{2}]^{+}\}}{c\{[Ag(NH_{3})]^{+}\}\cdot c(NH_{3})}$=$\frac{10^{-2.35}}{10^{-5.16}\times10^{-1}}$=10³.⁸¹,正确;D项,根据lgc(NH₃)= - 2时各曲线对应lgc(M),可知正确。
方法点拨
对于溶度积和平衡常数融合的曲线问题,一看起点,对于XY型饱和溶液,起点时对应阴、阳离子浓度相等;二看曲线走势,如本题中lgc(Ag⁺)随氨水浓度增大而减小,lgc(Cl⁻)随氨水浓度增大而增大,有的离子先增大后减小等;三作辅助线,如本题可以作一条lgc(NH₃)为 - 1或 - 2时的垂直于横坐标的竖直线,比较各离子浓度大小。
方法点拨
对于溶度积和平衡常数融合的曲线问题,一看起点,对于XY型饱和溶液,起点时对应阴、阳离子浓度相等;二看曲线走势,如本题中lgc(Ag⁺)随氨水浓度增大而减小,lgc(Cl⁻)随氨水浓度增大而增大,有的离子先增大后减小等;三作辅助线,如本题可以作一条lgc(NH₃)为 - 1或 - 2时的垂直于横坐标的竖直线,比较各离子浓度大小。
26.(2023辽宁,15,3分)某废水处理过程中始终保持H₂S饱和,即c(H₂S)=0.1mol·L⁻¹,通过调节pH使Ni²⁺和Cd²⁺形成硫化物而分离,体系中pH与 -lg c关系如图所示,c为HS⁻、S²⁻、Ni²⁺和Cd²⁺的浓度,单位为mol·L⁻¹。已知$K_{sp}(NiS)>K_{sp}(CdS),$下列说法正确的是( )

$A.K_{sp}(CdS)=10⁻¹⁸.⁴$
B.③为pH与 -lg c(HS⁻)的关系曲线
$C.K_{a1}(H₂S)=10⁻⁸.¹$
$D.K_{a2}(H₂S)=10⁻¹⁴.⁷$

$A.K_{sp}(CdS)=10⁻¹⁸.⁴$
B.③为pH与 -lg c(HS⁻)的关系曲线
$C.K_{a1}(H₂S)=10⁻⁸.¹$
$D.K_{a2}(H₂S)=10⁻¹⁴.⁷$
答案:
26D c(H₂S)始终为0.1 mol·L⁻¹,根据Kₐ可知,随着pH升高,c(HS⁻)和c(S²⁻)不断增大,且c(HS⁻)>c(S²⁻),据此判断曲线④和曲线③分别代表c(HS⁻)和c(S²⁻)的变化,再根据Kₛₚ(NiS)>Kₛₚ(CdS)判断曲线②和曲线①分别代表c(Ni²⁺)和c(Cd²⁺)的变化。由曲线③和曲线①的交点可计算出Kₛₚ(CdS)=c(Cd²⁺)·c(S²⁻)=10⁻¹³×10⁻¹³=10⁻²⁶,A项错误;③为pH与 - lg c(S²⁻)的关系曲线,B项错误;由曲线④上的点(1.6,6.5)可计算出Kₐ₁(H₂S)=$\frac{c(HS^{-})\cdot c(H^{+})}{c(H_{2}S)}$=$\frac{1.0^{-1.6}\times10^{-6.5}}{0.1}$=10⁻⁷.¹,C项错误;由曲线③上的点(4.9,13.0)可知,pH = 4.9时,c(S²⁻)=10⁻¹³ mol·L⁻¹,根据Kₐ₁=$\frac{c(H^{+})\cdot c(HS^{-})}{c(H_{2}S)}$,可得此时c(HS⁻)=10⁻³.² mol·L⁻¹,则Kₐ₂(H₂S)=$\frac{c(S^{2 -})\cdot c(H^{+})}{c(HS^{-})}$=$\frac{10^{-13}\times10^{-4.9}}{10^{-3.2}}$=10⁻¹⁴.⁷,D项正确。
27.(双选)(2023山东,15,4分)在含HgI₂(s)的溶液中,一定c(I⁻)范围内,存在平衡关系:HgI₂(s)⇌HgI₂(aq);HgI₂(aq)⇌Hg²⁺ + 2I⁻;HgI₂(aq)⇌HgI⁺ + I⁻;HgI₂(aq)+I⁻⇌HgI₃⁻;HgI₂(aq)+2I⁻⇌HgI₄²⁻,平衡常数依次为K₀、K₁、K₂、K₃、K₄。已知lgc(Hg²⁺)、lgc(HgI⁺)、lgc(HgI₃⁻)、lgc(HgI₄²⁻)随lgc(I⁻)的变化关系如图所示。下列说法错误的是( )

A.线L表示lgc(HgI₄²⁻)的变化情况
B.随c(I⁻)增大,c[HgI₂(aq)]先增大后减小
C.a = lg$\frac{K₁}{K₂}$
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1

A.线L表示lgc(HgI₄²⁻)的变化情况
B.随c(I⁻)增大,c[HgI₂(aq)]先增大后减小
C.a = lg$\frac{K₁}{K₂}$
D.溶液中I元素与Hg元素的物质的量之比始终为2∶1
答案:
27BD $K_{3}=\frac{c(HgI_{3}^{-})}{c[HgI_{2}(aq)]c(I^{-})}$,$K_{4}=\frac{c(HgI_{4}^{2 -})}{c[HgI_{2}(aq)]c^{2}(I^{-})}$,又K₀ = c[HgI₂(aq)],温度不变,c[HgI₂(aq)]为常数,则lg{K₃c[HgI₂(aq)]}+lgc(I⁻)=lgc(HgI₃⁻),lg{K₄c[HgI₂(aq)]}+2lgc(I⁻)=lgc(HgI₄²⁻),则lgc(HgI₃⁻)、lgc(HgI₄²⁻)分别对应斜率为1、2的直线,故斜率较大的线L表示lgc(HgI₄²⁻)的变化情况,A项正确、B项错误;$K_{1}=\frac{c(Hg^{2+})c^{2}(I^{-})}{c[HgI_{2}(aq)]}$,$K_{2}=\frac{c(HgI^{+})c(I^{-})}{c[HgI_{2}(aq)]}$,$\frac{K_{1}}{K_{2}}=\frac{c(Hg^{2+})c(I^{-})}{c(HgI^{+})}$,M点时,lgc(I⁻)=a,c(Hg²⁺)=c(HgI⁺),代入$\frac{K_{1}}{K_{2}}=\frac{c(Hg^{2+})c(I^{-})}{c(HgI^{+})}$,得$\frac{K_{1}}{K_{2}}$=c(I⁻),即lg$\frac{K_{1}}{K_{2}}$=lgc(I⁻)=a,C项正确;随着c(I⁻)的增大,由题图可知c(HgI₄²⁻)逐渐增大,溶液中I元素与Hg元素的物质的量之比逐渐增大,D项错误。
疑难突破
直线图像的出现,通常通过平衡常数进行对数处理所得。该题较为巧妙的是c[HgI₂(aq)]为常数。按照A项的分析类推可知lgc(Hg²⁺)、lgc(HgI⁺)分别对应斜率为 - 2、 - 1的直线。
疑难突破
直线图像的出现,通常通过平衡常数进行对数处理所得。该题较为巧妙的是c[HgI₂(aq)]为常数。按照A项的分析类推可知lgc(Hg²⁺)、lgc(HgI⁺)分别对应斜率为 - 2、 - 1的直线。
28.(2022重庆,11,3分)某小组模拟成垢—除垢过程如下。
100mL 0.1mol·L⁻¹ CaCl₂水溶液$\xrightarrow{①0.01mol Na₂SO₄}\xrightarrow{②0.02mol Na₂CO₃}\xrightarrow{③0.02mol冰醋酸}$……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca²⁺)+c(Na⁺)=c(Cl⁻)
B.经过步骤②,溶液中c(Na⁺)=4c(SO₄²⁻)
C.经过步骤②,溶液中c(Cl⁻)=c(CO₃²⁻)+c(HCO₃⁻)+c(H₂CO₃)
D.经过步骤③,溶液中c(CH₃COOH)+c(CH₃COO⁻)=c(Cl⁻)
100mL 0.1mol·L⁻¹ CaCl₂水溶液$\xrightarrow{①0.01mol Na₂SO₄}\xrightarrow{②0.02mol Na₂CO₃}\xrightarrow{③0.02mol冰醋酸}$……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A.经过步骤①,溶液中c(Ca²⁺)+c(Na⁺)=c(Cl⁻)
B.经过步骤②,溶液中c(Na⁺)=4c(SO₄²⁻)
C.经过步骤②,溶液中c(Cl⁻)=c(CO₃²⁻)+c(HCO₃⁻)+c(H₂CO₃)
D.经过步骤③,溶液中c(CH₃COOH)+c(CH₃COO⁻)=c(Cl⁻)
答案:
28D 步骤①中0.01 mol CaCl₂和0.01 mol Na₂SO₄反应:CaCl₂ + Na₂SO₄ = 2NaCl + CaSO₄↓,生成0.02 mol NaCl和0.01 mol CaSO₄,CaSO₄微溶,溶液中含有SO₄²⁻和Ca²⁺,存在c(Na⁺)=c(Cl⁻),即c(Ca²⁺)+c(Na⁺)>c(Cl⁻),A错误;步骤②中发生反应:CaSO₄(s)+Na₂CO₃(aq)=CaCO₃(s)+Na₂SO₄(aq),反应后溶液中的溶质为0.01 mol Na₂SO₄、0.01 mol Na₂CO₃和0.02 mol NaCl,则溶液中c(Na⁺)=6c(SO₄²⁻),根据元素守恒有:c(Cl⁻)≠c(CO₃²⁻)+c(HCO₃⁻)+c(H₂CO₃),B、C错误;经过步骤③n(Cl⁻)=0.02 mol,n(CH₃COOH)+n(CH₃COO⁻)=0.02 mol,故c(CH₃COOH)+c(CH₃COO⁻)=c(Cl⁻),D正确。
查看更多完整答案,请扫码查看


