2025年5年高考3年模拟高中化学全一册人教B版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学全一册人教B版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第117页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
36.(2022海南,16,10分)某空间站的生命保障系统功能之一是实现氧循环。其中涉及反应:
CO₂(g)+4H₂(g)→(催化剂)2H₂O(g)+CH₄(g)
回答问题:
(1)已知:电解液态水制备1 mol O₂(g),电解反应的ΔH=+572 kJ·mol⁻¹。由此计算H₂(g)的燃烧热(焓)ΔH=______kJ·mol⁻¹。
(2)已知:CO₂(g)+4H₂(g)⇌2H₂O(g)+CH₄(g)的平衡常数(K)与反应温度(t)之间的关系如图1所示。

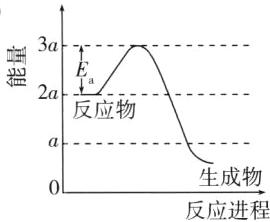
①若反应为基元反应,且反应的ΔH与活化能(Eₐ)的关系为|ΔH|>Eₐ。补充完成该反应过程的能量变化示意图(图2)。

②某研究小组模拟该反应。温度t下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO₂和0.4 mol H₂,反应平衡后测得容器中n(CH₄)=0.05 mol。则CO₂的转化率为______,反应温度t约为______℃。
(3)在相同条件下,CO₂(g)与H₂(g)还会发生不利于氧循环的副反应:
CO₂(g)+3H₂(g)⇌H₂O(g)+CH₃OH(g)
在反应器中按n(CO₂)∶n(H₂)=1∶4通入反应物,在不同温度、不同催化剂条件下,反应进行到2 min时,测得反应器中CH₃OH、CH₄浓度(μmol·L⁻¹)如下表所示。

在选择使用催化剂Ⅰ和350 ℃条件下反应,0~2 min生成CH₃OH的平均反应速率为______μmol·L⁻¹·min⁻¹;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400 ℃的反应条件,原因是______________________________。
CO₂(g)+4H₂(g)→(催化剂)2H₂O(g)+CH₄(g)
回答问题:
(1)已知:电解液态水制备1 mol O₂(g),电解反应的ΔH=+572 kJ·mol⁻¹。由此计算H₂(g)的燃烧热(焓)ΔH=______kJ·mol⁻¹。
(2)已知:CO₂(g)+4H₂(g)⇌2H₂O(g)+CH₄(g)的平衡常数(K)与反应温度(t)之间的关系如图1所示。

①若反应为基元反应,且反应的ΔH与活化能(Eₐ)的关系为|ΔH|>Eₐ。补充完成该反应过程的能量变化示意图(图2)。

②某研究小组模拟该反应。温度t下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO₂和0.4 mol H₂,反应平衡后测得容器中n(CH₄)=0.05 mol。则CO₂的转化率为______,反应温度t约为______℃。
(3)在相同条件下,CO₂(g)与H₂(g)还会发生不利于氧循环的副反应:
CO₂(g)+3H₂(g)⇌H₂O(g)+CH₃OH(g)
在反应器中按n(CO₂)∶n(H₂)=1∶4通入反应物,在不同温度、不同催化剂条件下,反应进行到2 min时,测得反应器中CH₃OH、CH₄浓度(μmol·L⁻¹)如下表所示。

在选择使用催化剂Ⅰ和350 ℃条件下反应,0~2 min生成CH₃OH的平均反应速率为______μmol·L⁻¹·min⁻¹;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400 ℃的反应条件,原因是______________________________。
答案:
答案
(1)- 286
(2)①
②50% 660.2(或660.1或660.3,其他合理答案也可)
(3)5.4 相同催化剂,400℃的反应速率更快;相同温度,催化剂Ⅱ副产物浓度低,而甲烷的比例高
解析
(1)根据题给信息写出$2H_{2}O(l)\xlongequal{电解}2H_{2}(g)+O_{2}(g)$ $\Delta H=+572\ kJ\cdot mol^{-1}$可得$2H_{2}(g)+O_{2}(g)\longrightarrow 2H_{2}O(l)$ $\Delta H=-572\ kJ\cdot mol^{-1}$,则$H_{2}(g)$的燃烧热[1 mol可燃物]为$\Delta H=(-572\div2)\ kJ\cdot mol^{-1}=-286\ kJ\cdot mol^{-1}$。
(2)①根据题图1可知温度越高,平衡常数越小,则$CO_{2}(g)+4H_{2}(g)\xrightarrow{催化剂}2H_{2}O(g)+CH_{4}(g)$ $\Delta H<0$;$|\Delta H|>E_{a}=a$,则反应物总能量与生成物总能量之差大于a,故生成物总能量低于a[不仅算清,作图时还要看清纵坐标数据]。
②利用三段式法解答:
$CO_{2}(g)+4H_{2}(g)\xrightarrow{催化剂}2H_{2}O(g)+CH_{4}(g)$
起始(mol) 0.1 0.4 0 0
转化(mol) 0.05 0.2 0.1 0.05
平衡(mol) 0.05 0.2 0.1 0.05
$CO_{2}$的平衡转化率为$\frac{0.05}{0.1}×100\%=50\%$,反应的平衡常数$K=\frac{(\frac{0.1}{10})^{2}×\frac{0.05}{10}}{\frac{0.05}{10}×(\frac{0.2}{10})^{4}}=625$,由题图1可知对应温度约为660.2℃。
(3)$v(CH_{3}OH)=\frac{\Delta c(CH_{3}OH)}{\Delta t}=\frac{10.8\ \mu mol\cdot L^{-1}}{2\ min}=5.4\ \mu mol\cdot L^{-1}\cdot min^{-1}$。催化剂相同时,温度越高反应速率越快;对比表格中数据可知温度相同时,使用催化剂Ⅱ比催化剂Ⅰ生成的甲醇(副产物)浓度小。
方法指导
第
(2)问中①题画图时,关键要找到生成物总能量数值(即最低点);第
(3)问分析表格中数据时,注意控制变量分析外界条件对反应的影响。
答案
(1)- 286
(2)①

②50% 660.2(或660.1或660.3,其他合理答案也可)
(3)5.4 相同催化剂,400℃的反应速率更快;相同温度,催化剂Ⅱ副产物浓度低,而甲烷的比例高
解析
(1)根据题给信息写出$2H_{2}O(l)\xlongequal{电解}2H_{2}(g)+O_{2}(g)$ $\Delta H=+572\ kJ\cdot mol^{-1}$可得$2H_{2}(g)+O_{2}(g)\longrightarrow 2H_{2}O(l)$ $\Delta H=-572\ kJ\cdot mol^{-1}$,则$H_{2}(g)$的燃烧热[1 mol可燃物]为$\Delta H=(-572\div2)\ kJ\cdot mol^{-1}=-286\ kJ\cdot mol^{-1}$。
(2)①根据题图1可知温度越高,平衡常数越小,则$CO_{2}(g)+4H_{2}(g)\xrightarrow{催化剂}2H_{2}O(g)+CH_{4}(g)$ $\Delta H<0$;$|\Delta H|>E_{a}=a$,则反应物总能量与生成物总能量之差大于a,故生成物总能量低于a[不仅算清,作图时还要看清纵坐标数据]。
②利用三段式法解答:
$CO_{2}(g)+4H_{2}(g)\xrightarrow{催化剂}2H_{2}O(g)+CH_{4}(g)$
起始(mol) 0.1 0.4 0 0
转化(mol) 0.05 0.2 0.1 0.05
平衡(mol) 0.05 0.2 0.1 0.05
$CO_{2}$的平衡转化率为$\frac{0.05}{0.1}×100\%=50\%$,反应的平衡常数$K=\frac{(\frac{0.1}{10})^{2}×\frac{0.05}{10}}{\frac{0.05}{10}×(\frac{0.2}{10})^{4}}=625$,由题图1可知对应温度约为660.2℃。
(3)$v(CH_{3}OH)=\frac{\Delta c(CH_{3}OH)}{\Delta t}=\frac{10.8\ \mu mol\cdot L^{-1}}{2\ min}=5.4\ \mu mol\cdot L^{-1}\cdot min^{-1}$。催化剂相同时,温度越高反应速率越快;对比表格中数据可知温度相同时,使用催化剂Ⅱ比催化剂Ⅰ生成的甲醇(副产物)浓度小。
方法指导
第
(2)问中①题画图时,关键要找到生成物总能量数值(即最低点);第
(3)问分析表格中数据时,注意控制变量分析外界条件对反应的影响。
37.(2022河北,16,14分)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)298 K时,1 g H₂燃烧生成H₂O(g)放热121 kJ,1 mol H₂O(l)蒸发吸热44 kJ。表示H₂燃烧热的热化学方程式为______________________________。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ CH₄(g)+H₂O(g)⇌CO(g)+3H₂(g)
Ⅱ CO(g)+H₂O(g)⇌CO₂(g)+H₂(g)
①下列操作中,能提高CH₄(g)平衡转化率的是______(填标号)。
A.增加CH₄(g)用量
B.恒温恒压下通入惰性气体
C.移除CO(g)
D.加入催化剂
②恒温恒压条件下,1 mol CH₄(g)和1 mol H₂O(g)反应达平衡时,CH₄(g)的转化率为α,CO₂(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kₓ=________________[写出含有α、b的计算式;对于反应mA(g)+nB(g)⇌pC(g)+qD(g),Kₓ=xᵖ(C)·xᵠ(D)/[xᵐ(A)·xⁿ(B)],x为物质的量分数]。其他条件不变,H₂O(g)起始量增加到5 mol,达平衡时α=0.90,b=0.65,平衡体系中H₂(g)的物质的量分数为______(结果保留两位有效数字)。
(3)氢氧燃料电池中氢气在______(填“正”或“负”)极发生反应。
(4)在允许O²⁻自由迁移的固体电解质燃料电池中,CₙH₂ₙ₊₂放电的电极反应式为______________________________。
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→________(用b~j等代号表示)。

(1)298 K时,1 g H₂燃烧生成H₂O(g)放热121 kJ,1 mol H₂O(l)蒸发吸热44 kJ。表示H₂燃烧热的热化学方程式为______________________________。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ CH₄(g)+H₂O(g)⇌CO(g)+3H₂(g)
Ⅱ CO(g)+H₂O(g)⇌CO₂(g)+H₂(g)
①下列操作中,能提高CH₄(g)平衡转化率的是______(填标号)。
A.增加CH₄(g)用量
B.恒温恒压下通入惰性气体
C.移除CO(g)
D.加入催化剂
②恒温恒压条件下,1 mol CH₄(g)和1 mol H₂O(g)反应达平衡时,CH₄(g)的转化率为α,CO₂(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kₓ=________________[写出含有α、b的计算式;对于反应mA(g)+nB(g)⇌pC(g)+qD(g),Kₓ=xᵖ(C)·xᵠ(D)/[xᵐ(A)·xⁿ(B)],x为物质的量分数]。其他条件不变,H₂O(g)起始量增加到5 mol,达平衡时α=0.90,b=0.65,平衡体系中H₂(g)的物质的量分数为______(结果保留两位有效数字)。
(3)氢氧燃料电池中氢气在______(填“正”或“负”)极发生反应。
(4)在允许O²⁻自由迁移的固体电解质燃料电池中,CₙH₂ₙ₊₂放电的电极反应式为______________________________。
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→________(用b~j等代号表示)。

答案:
答案
(1)$H_{2}(g)+\frac{1}{2}O_{2}(g)\longrightarrow H_{2}O(l)$ $\Delta H=-286\ kJ\cdot mol^{-1}$
(2)①BC ②$\frac{(\alpha - b)(3\alpha + b)^{3}}{(1 - \alpha)(1 - \alpha - b)(2 + 2\alpha)^{2}}$ 0.43
(3)负
(4)$C_{n}H_{2n + 2}-(6n + 2)e^{-}+(3n + 1)O^{2-}\longrightarrow nCO_{2}+(n + 1)H_{2}O$
(5)b→e→h→j
解析
(1)298 K时,1 g即0.5 mol $H_{2}$燃烧生成$H_{2}O(g)$放热121 kJ,1 mol $H_{2}O(l)$蒸发吸热44 kJ,则1 mol $H_{2}$燃烧生成1 mol $H_{2}O(l)$放热$2×121\ kJ+44\ kJ=286\ kJ$,表示$H_{2}$燃烧热的热化学方程式为$H_{2}(g)+\frac{1}{2}O_{2}(g)\longrightarrow H_{2}O(l)$ $\Delta H=-286\ kJ\cdot mol^{-1}$。
(2)①增加$CH_{4}(g)$用量可以提高$H_{2}O(g)$的转化率,但是$CH_{4}(g)$平衡转化率减小[注意总结规律];恒温恒压下通入惰性气体,相当于减小体系压强,反应Ⅰ的化学平衡正向移动,能提高$CH_{4}(g)$平衡转化率;移除$CO(g)$,$CO(g)$的浓度减小,反应Ⅰ的平衡正向移动,能提高$CH_{4}(g)$平衡转化率;催化剂不能改变平衡状态,故不能提高$CH_{4}(g)$平衡转化率;故选BC。
②恒温恒压条件下,1 mol $CH_{4}(g)$和1 mol $H_{2}O(g)$反应达平衡时,$CH_{4}(g)$的转化率为$\alpha$,列三段式[假设反应Ⅰ平衡后再发生反应Ⅱ]:
$CH_{4}(g)+H_{2}O(g)\rightleftharpoons CO(g)+3H_{2}(g)$
起始(mol) 1 1 0 0
转化(mol) $\alpha$ $\alpha$ $\alpha$ 3$\alpha$
平衡(mol) 1 - $\alpha$ 1 - $\alpha$ $\alpha$ 3$\alpha$
$CO(g)+H_{2}O(g)\rightleftharpoons CO_{2}(g)+H_{2}(g)$
起始(mol) $\alpha$ 1 - $\alpha$ 0 3$\alpha$
转化(mol) b b b b
平衡(mol) $\alpha - b$ 1 - $\alpha - b$ b 3$\alpha + b$
可知达平衡时,$CO_{2}(g)$的物质的量为b mol,$CH_{4}(g)$的物质的量为(1 - $\alpha$) mol,$CO(g)$的物质的量为($\alpha - b$) mol,$H_{2}O(g)$的物质的量为(1 - $\alpha - b$) mol,$H_{2}(g)$的物质的量为(3$\alpha + b$) mol,则反应达平衡时混合气体的总物质的量为(2$\alpha + 2$) mol[不要忘记体系中所有气体的物质的量都要算],混合气体中,$CH_{4}(g)$、$H_{2}O(g)$、$CO(g)$、$H_{2}(g)$的物质的量分数分别为$\frac{1 - \alpha}{2 + 2\alpha}$、$\frac{1 - \alpha - b}{2 + 2\alpha}$、$\frac{\alpha - b}{2 + 2\alpha}$、$\frac{3\alpha + b}{2 + 2\alpha}$,因此,反应Ⅰ的平衡常数$K_{x}=\frac{\frac{\alpha - b}{2 + 2\alpha}×(\frac{3\alpha + b}{2 + 2\alpha})^{3}}{\frac{1 - \alpha}{2 + 2\alpha}×\frac{1 - \alpha - b}{2 + 2\alpha}}=\frac{(\alpha - b)(3\alpha + b)^{3}}{(1 - \alpha)(1 - \alpha - b)(2 + 2\alpha)^{2}}$;其他条件不变,$H_{2}O(g)$起始量增加到5 mol,达平衡时,$\alpha = 0.90$,$b = 0.65$,则平衡时$CH_{4}(g)$的物质的量为(1 - 0.90) mol = 0.1 mol,$CO(g)$的物质的量为(0.90 - 0.65) mol = 0.25 mol,$H_{2}O(g)$的物质的量为(5 - 0.90 - 0.65) mol = 3.45 mol,$H_{2}(g)$的物质的量为(3×0.90 + 0.65) mol = 3.35 mol,则混合气体的总物质的量为(0.65 + 0.1 + 0.25 + 3.45 + 3.35) mol = 7.8 mol,平衡体系中$H_{2}(g)$的物质的量分数为$\frac{3.35\ mol}{7.8\ mol}\approx0.43$。
(3)燃料电池中燃料在负极发生氧化反应。
(4)在允许$O^{2-}$自由迁移的固体电解质燃料电池中,$C_{n}H_{2n + 2}$在负极发生氧化反应生成$CO_{2}$和$H_{2}O$。
(5)$CH_{3}OH$脱氢个数相同时,脱氢产物的相对能量越低,越有利于反应进行,所以最可行的途径为a→b→e→h→j。
快解方法
对于连锁可逆反应的三段式关系,在计算时可将第一个反应的平衡状态视为第二个反应的起始状态;同时注意题给信息中物质的量分数平衡常数表达式的应用。
(1)$H_{2}(g)+\frac{1}{2}O_{2}(g)\longrightarrow H_{2}O(l)$ $\Delta H=-286\ kJ\cdot mol^{-1}$
(2)①BC ②$\frac{(\alpha - b)(3\alpha + b)^{3}}{(1 - \alpha)(1 - \alpha - b)(2 + 2\alpha)^{2}}$ 0.43
(3)负
(4)$C_{n}H_{2n + 2}-(6n + 2)e^{-}+(3n + 1)O^{2-}\longrightarrow nCO_{2}+(n + 1)H_{2}O$
(5)b→e→h→j
解析
(1)298 K时,1 g即0.5 mol $H_{2}$燃烧生成$H_{2}O(g)$放热121 kJ,1 mol $H_{2}O(l)$蒸发吸热44 kJ,则1 mol $H_{2}$燃烧生成1 mol $H_{2}O(l)$放热$2×121\ kJ+44\ kJ=286\ kJ$,表示$H_{2}$燃烧热的热化学方程式为$H_{2}(g)+\frac{1}{2}O_{2}(g)\longrightarrow H_{2}O(l)$ $\Delta H=-286\ kJ\cdot mol^{-1}$。
(2)①增加$CH_{4}(g)$用量可以提高$H_{2}O(g)$的转化率,但是$CH_{4}(g)$平衡转化率减小[注意总结规律];恒温恒压下通入惰性气体,相当于减小体系压强,反应Ⅰ的化学平衡正向移动,能提高$CH_{4}(g)$平衡转化率;移除$CO(g)$,$CO(g)$的浓度减小,反应Ⅰ的平衡正向移动,能提高$CH_{4}(g)$平衡转化率;催化剂不能改变平衡状态,故不能提高$CH_{4}(g)$平衡转化率;故选BC。
②恒温恒压条件下,1 mol $CH_{4}(g)$和1 mol $H_{2}O(g)$反应达平衡时,$CH_{4}(g)$的转化率为$\alpha$,列三段式[假设反应Ⅰ平衡后再发生反应Ⅱ]:
$CH_{4}(g)+H_{2}O(g)\rightleftharpoons CO(g)+3H_{2}(g)$
起始(mol) 1 1 0 0
转化(mol) $\alpha$ $\alpha$ $\alpha$ 3$\alpha$
平衡(mol) 1 - $\alpha$ 1 - $\alpha$ $\alpha$ 3$\alpha$
$CO(g)+H_{2}O(g)\rightleftharpoons CO_{2}(g)+H_{2}(g)$
起始(mol) $\alpha$ 1 - $\alpha$ 0 3$\alpha$
转化(mol) b b b b
平衡(mol) $\alpha - b$ 1 - $\alpha - b$ b 3$\alpha + b$
可知达平衡时,$CO_{2}(g)$的物质的量为b mol,$CH_{4}(g)$的物质的量为(1 - $\alpha$) mol,$CO(g)$的物质的量为($\alpha - b$) mol,$H_{2}O(g)$的物质的量为(1 - $\alpha - b$) mol,$H_{2}(g)$的物质的量为(3$\alpha + b$) mol,则反应达平衡时混合气体的总物质的量为(2$\alpha + 2$) mol[不要忘记体系中所有气体的物质的量都要算],混合气体中,$CH_{4}(g)$、$H_{2}O(g)$、$CO(g)$、$H_{2}(g)$的物质的量分数分别为$\frac{1 - \alpha}{2 + 2\alpha}$、$\frac{1 - \alpha - b}{2 + 2\alpha}$、$\frac{\alpha - b}{2 + 2\alpha}$、$\frac{3\alpha + b}{2 + 2\alpha}$,因此,反应Ⅰ的平衡常数$K_{x}=\frac{\frac{\alpha - b}{2 + 2\alpha}×(\frac{3\alpha + b}{2 + 2\alpha})^{3}}{\frac{1 - \alpha}{2 + 2\alpha}×\frac{1 - \alpha - b}{2 + 2\alpha}}=\frac{(\alpha - b)(3\alpha + b)^{3}}{(1 - \alpha)(1 - \alpha - b)(2 + 2\alpha)^{2}}$;其他条件不变,$H_{2}O(g)$起始量增加到5 mol,达平衡时,$\alpha = 0.90$,$b = 0.65$,则平衡时$CH_{4}(g)$的物质的量为(1 - 0.90) mol = 0.1 mol,$CO(g)$的物质的量为(0.90 - 0.65) mol = 0.25 mol,$H_{2}O(g)$的物质的量为(5 - 0.90 - 0.65) mol = 3.45 mol,$H_{2}(g)$的物质的量为(3×0.90 + 0.65) mol = 3.35 mol,则混合气体的总物质的量为(0.65 + 0.1 + 0.25 + 3.45 + 3.35) mol = 7.8 mol,平衡体系中$H_{2}(g)$的物质的量分数为$\frac{3.35\ mol}{7.8\ mol}\approx0.43$。
(3)燃料电池中燃料在负极发生氧化反应。
(4)在允许$O^{2-}$自由迁移的固体电解质燃料电池中,$C_{n}H_{2n + 2}$在负极发生氧化反应生成$CO_{2}$和$H_{2}O$。
(5)$CH_{3}OH$脱氢个数相同时,脱氢产物的相对能量越低,越有利于反应进行,所以最可行的途径为a→b→e→h→j。
快解方法
对于连锁可逆反应的三段式关系,在计算时可将第一个反应的平衡状态视为第二个反应的起始状态;同时注意题给信息中物质的量分数平衡常数表达式的应用。
查看更多完整答案,请扫码查看


