2025年5年高考3年模拟高中化学全一册人教B版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学全一册人教B版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
- 第229页
- 第230页
- 第231页
- 第232页
- 第233页
- 第234页
- 第235页
- 第236页
- 第237页
- 第238页
- 第239页
- 第240页
- 第241页
- 第242页
- 第243页
- 第244页
- 第245页
- 第246页
- 第247页
- 第248页
- 第249页
- 第250页
- 第251页
- 第252页
- 第253页
- 第254页
- 第255页
- 第256页
- 第257页
- 第258页
- 第259页
- 第260页
- 第261页
- 第262页
- 第263页
- 第264页
- 第265页
- 第266页
- 第267页
- 第268页
- 第269页
25.(2024江西,15,14分)稀土是国家的战略资源之一。以下是一种以独居石[主要成分为CePO₄,含有Th₃(PO₄)₄、U₃O₈和少量镭杂质]为原料制备CeCl₃·nH₂O的工艺流程图。
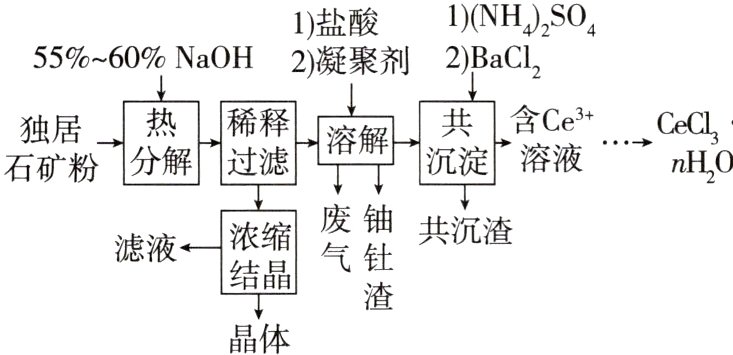
已知:ⅰ.$K_{sp}[Th(OH)_{4}]=4.0×10^{-45}$,$K_{sp}[Ce(OH)_{3}]=1.6×10^{-20}$,$K_{sp}[Ce(OH)_{4}]=2.0×10^{-48}$
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是_______(填标号)。
a.降低压强,分解速率增大
b.降低温度,分解速率降低
c.反应时间越长,分解速率越大
d.提高搅拌速度,分解速率降低
(2)$Na_{2}U_{2}O_{7}$中铀元素的化合价为_______,热分解阶段$U_{3}O_{8}$生成$Na_{2}U_{2}O_{7}$的化学反应方程式为____________________。
(3)浓缩结晶后,得到的晶体产物化学式为_______。滤液可用于_______阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解$Ce(OH)_{4}$的离子方程式为____________________。
②当溶液pH=4.5时,$c(Th^{4+})=$_______mol/L,此时完全转化为氢氧化钍沉淀。
(5)以$BaSO_{4}$为载体形成共沉淀,目的是去除杂质_______。

已知:ⅰ.$K_{sp}[Th(OH)_{4}]=4.0×10^{-45}$,$K_{sp}[Ce(OH)_{3}]=1.6×10^{-20}$,$K_{sp}[Ce(OH)_{4}]=2.0×10^{-48}$
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是_______(填标号)。
a.降低压强,分解速率增大
b.降低温度,分解速率降低
c.反应时间越长,分解速率越大
d.提高搅拌速度,分解速率降低
(2)$Na_{2}U_{2}O_{7}$中铀元素的化合价为_______,热分解阶段$U_{3}O_{8}$生成$Na_{2}U_{2}O_{7}$的化学反应方程式为____________________。
(3)浓缩结晶后,得到的晶体产物化学式为_______。滤液可用于_______阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解$Ce(OH)_{4}$的离子方程式为____________________。
②当溶液pH=4.5时,$c(Th^{4+})=$_______mol/L,此时完全转化为氢氧化钍沉淀。
(5)以$BaSO_{4}$为载体形成共沉淀,目的是去除杂质_______。
答案:
答案
(1)b
(2)+6 $O_{2}+2U_{3}O_{8}+6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7}+3H_{2}O$
(3)$Na_{3}PO_{4}$ 热分解
(4)①$2Ce(OH)_{4}+8H^{+}+2Cl^{-}\xlongequal{\;}2Ce^{3+}+Cl_{2}\uparrow +8H_{2}O$ ②$4.0\times10^{-7}$
(5)镭
解析
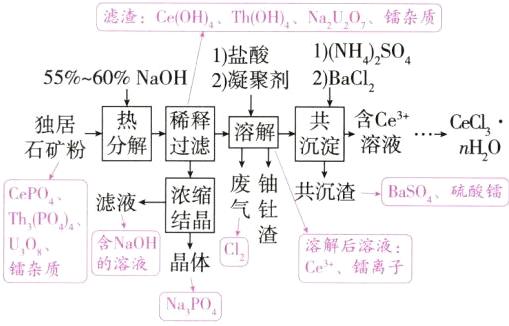
(1)a项,独居石的热分解需要有$O_{2}$参加,降低压强,$O_{2}$浓度降低,分解速率减小,错误;b项,降低温度,分解速率降低,正确;c项,反应时间越长,反应物浓度越低,分解速率越小,错误;d项,提高搅拌速度可使反应物接触更充分,分解速率加快,错误。
(2)$Na_{2}U_{2}O_{7}$中$U$元素的化合价为+6,$U_{3}O_{8}$转化为$Na_{2}U_{2}O_{7}$过程中$U$被氧化,则该过程中有$O_{2}$参加,则反应的化学方程式为$O_{2}+2U_{3}O_{8}+6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7}+3H_{2}O$。
(3)由流程分析可知晶体为$Na_{3}PO_{4}$,滤液中含有$NaOH$,可用于热分解阶段循环利用。
(4)①由流程分析可知,$Ce(OH)_{4}$与盐酸反应的离子方程式为$2Ce(OH)_{4}+8H^{+}+2Cl^{-}\xlongequal{\;}2Ce^{3+}+Cl_{2}\uparrow +8H_{2}O$。②当溶液$pH = 4.5$时,$c(OH^{-})=\frac{K_{W}}{c(H^{+})}=\frac{10^{-14}}{10^{-4.5}}mol/L = 10^{-9.5}mol/L$,$c(Th^{4+})=\frac{K_{sp}[Th(OH)_{4}]}{c^{4}(OH^{-})}=\frac{4.0\times10^{-45}}{(10^{-9.5})^{4}}mol/L = 4.0\times10^{-7}mol/L$。
答案
(1)b
(2)+6 $O_{2}+2U_{3}O_{8}+6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7}+3H_{2}O$
(3)$Na_{3}PO_{4}$ 热分解
(4)①$2Ce(OH)_{4}+8H^{+}+2Cl^{-}\xlongequal{\;}2Ce^{3+}+Cl_{2}\uparrow +8H_{2}O$ ②$4.0\times10^{-7}$
(5)镭
解析

(1)a项,独居石的热分解需要有$O_{2}$参加,降低压强,$O_{2}$浓度降低,分解速率减小,错误;b项,降低温度,分解速率降低,正确;c项,反应时间越长,反应物浓度越低,分解速率越小,错误;d项,提高搅拌速度可使反应物接触更充分,分解速率加快,错误。
(2)$Na_{2}U_{2}O_{7}$中$U$元素的化合价为+6,$U_{3}O_{8}$转化为$Na_{2}U_{2}O_{7}$过程中$U$被氧化,则该过程中有$O_{2}$参加,则反应的化学方程式为$O_{2}+2U_{3}O_{8}+6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7}+3H_{2}O$。
(3)由流程分析可知晶体为$Na_{3}PO_{4}$,滤液中含有$NaOH$,可用于热分解阶段循环利用。
(4)①由流程分析可知,$Ce(OH)_{4}$与盐酸反应的离子方程式为$2Ce(OH)_{4}+8H^{+}+2Cl^{-}\xlongequal{\;}2Ce^{3+}+Cl_{2}\uparrow +8H_{2}O$。②当溶液$pH = 4.5$时,$c(OH^{-})=\frac{K_{W}}{c(H^{+})}=\frac{10^{-14}}{10^{-4.5}}mol/L = 10^{-9.5}mol/L$,$c(Th^{4+})=\frac{K_{sp}[Th(OH)_{4}]}{c^{4}(OH^{-})}=\frac{4.0\times10^{-45}}{(10^{-9.5})^{4}}mol/L = 4.0\times10^{-7}mol/L$。
26.(2024山东,18,12分)以铅精矿(含PbS、$Ag_{2}S$等)为主要原料提取金属Pb和Ag的工艺流程如下:

回答下列问题:
(1)“热浸”时,难溶的PbS和$Ag_{2}S$转化为$[PbCl_{4}]^{2-}$和$[AgCl_{2}]^{-}$及单质硫。溶解等物质的量的PbS和$Ag_{2}S$时,消耗$Fe^{3+}$物质的量之比为_______;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生_______(填化学式)。
(2)将“过滤Ⅱ”得到的$PbCl_{2}$沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属Pb。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______。
(3)“还原”中加入铅精矿的目的是____________________。
(4)“置换”中可选用的试剂X为_______(填标号);
A.Al B.Zn C.Pb D.Ag
“置换”反应的离子方程式为____________________。
(5)“电解Ⅱ”中将富银铅泥制成电极板,用作_______(填“阴极”或“阳极”)。

回答下列问题:
(1)“热浸”时,难溶的PbS和$Ag_{2}S$转化为$[PbCl_{4}]^{2-}$和$[AgCl_{2}]^{-}$及单质硫。溶解等物质的量的PbS和$Ag_{2}S$时,消耗$Fe^{3+}$物质的量之比为_______;溶液中盐酸浓度不宜过大,除防止“热浸”时HCl挥发外,另一目的是防止产生_______(填化学式)。
(2)将“过滤Ⅱ”得到的$PbCl_{2}$沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属Pb。“电解Ⅰ”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______。
(3)“还原”中加入铅精矿的目的是____________________。
(4)“置换”中可选用的试剂X为_______(填标号);
A.Al B.Zn C.Pb D.Ag
“置换”反应的离子方程式为____________________。
(5)“电解Ⅱ”中将富银铅泥制成电极板,用作_______(填“阴极”或“阳极”)。
答案:
答案
(1)1:1 $H_{2}S$
(2)热浸
(3)还原过量的$FeCl_{3}$
(4)C $Pb + 2[AgCl_{2}]^{-}\xlongequal{\;}2Ag+[PbCl_{4}]^{2 - }$
(5)阳极
解析
(1)“热浸”时发生反应:$PbS + 2Fe^{3+}+4Cl^{-}\xlongequal{\;}[PbCl_{4}]^{2 - }+2Fe^{2+}+S$、$Ag_{2}S + 2Fe^{3+}+4Cl^{-}\xlongequal{\;}2[AgCl_{2}]^{-}+2Fe^{2+}+S$,故消耗$Fe^{3+}$的物质的量之比为1:1。加热时浓盐酸可与$PbS$反应生成$H_{2}S$气体,故盐酸浓度不宜过大。
(2)电解含$[PbCl_{4}]^{2 - }$的溶液得到$Pb$,阴极反应式为$[PbCl_{4}]^{2 - }+2e^{-}\xlongequal{\;}Pb + 4Cl^{-}$,阳极反应式为$2Cl^{-}-2e^{-}\xlongequal{\;}Cl_{2}\uparrow$;尾液中含有$FeCl_{2}$,用$FeCl_{2}$吸收$Cl_{2}$后生成$FeCl_{3}$,该吸收液可在“热浸”操作单元循环使用。
(3)在“热浸”操作中加入了过量$FeCl_{3}$,则在“还原”操作中加入铅精矿的目的为还原过量的$FeCl_{3}$。
(4)为避免引入杂质离子,试剂$X$可选用$Pb$。
(5)将富银铅泥制成电极板进行精炼,故应以含$[PbCl_{4}]^{2 - }$的溶液作电解液,富银铅泥电极板作阳极,$Pb$在阳极放电失去电子,$[PbCl_{4}]^{2 - }$在阴极得到电子生成$Pb$。
(1)1:1 $H_{2}S$
(2)热浸
(3)还原过量的$FeCl_{3}$
(4)C $Pb + 2[AgCl_{2}]^{-}\xlongequal{\;}2Ag+[PbCl_{4}]^{2 - }$
(5)阳极
解析
(1)“热浸”时发生反应:$PbS + 2Fe^{3+}+4Cl^{-}\xlongequal{\;}[PbCl_{4}]^{2 - }+2Fe^{2+}+S$、$Ag_{2}S + 2Fe^{3+}+4Cl^{-}\xlongequal{\;}2[AgCl_{2}]^{-}+2Fe^{2+}+S$,故消耗$Fe^{3+}$的物质的量之比为1:1。加热时浓盐酸可与$PbS$反应生成$H_{2}S$气体,故盐酸浓度不宜过大。
(2)电解含$[PbCl_{4}]^{2 - }$的溶液得到$Pb$,阴极反应式为$[PbCl_{4}]^{2 - }+2e^{-}\xlongequal{\;}Pb + 4Cl^{-}$,阳极反应式为$2Cl^{-}-2e^{-}\xlongequal{\;}Cl_{2}\uparrow$;尾液中含有$FeCl_{2}$,用$FeCl_{2}$吸收$Cl_{2}$后生成$FeCl_{3}$,该吸收液可在“热浸”操作单元循环使用。
(3)在“热浸”操作中加入了过量$FeCl_{3}$,则在“还原”操作中加入铅精矿的目的为还原过量的$FeCl_{3}$。
(4)为避免引入杂质离子,试剂$X$可选用$Pb$。
(5)将富银铅泥制成电极板进行精炼,故应以含$[PbCl_{4}]^{2 - }$的溶液作电解液,富银铅泥电极板作阳极,$Pb$在阳极放电失去电子,$[PbCl_{4}]^{2 - }$在阴极得到电子生成$Pb$。
27.(2023海南,15,14分)铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿
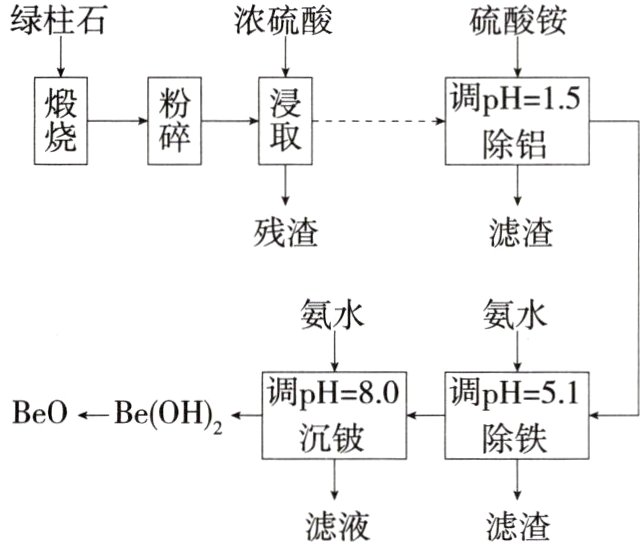
回答问题:
(1)$Be_{3}Al_{2}Si_{6}O_{18}$中Be的化合价为_______。
(2)粉碎的目的是____________________;残渣的主要成分是_______(填化学式)。
(3)该流程中能循环使用的物质是_______(填化学式)。
(4)无水$BeCl_{2}$可用作聚合反应的催化剂。$BeO$、$Cl_{2}$与足量C在600~800℃制备$BeCl_{2}$的化学方程式为____________________。
(5)沉铍时,将pH从8.0提高到8.5,则铍的损失降低至原来的_______%。

回答问题:
(1)$Be_{3}Al_{2}Si_{6}O_{18}$中Be的化合价为_______。
(2)粉碎的目的是____________________;残渣的主要成分是_______(填化学式)。
(3)该流程中能循环使用的物质是_______(填化学式)。
(4)无水$BeCl_{2}$可用作聚合反应的催化剂。$BeO$、$Cl_{2}$与足量C在600~800℃制备$BeCl_{2}$的化学方程式为____________________。
(5)沉铍时,将pH从8.0提高到8.5,则铍的损失降低至原来的_______%。
答案:
答案
(1)+2
(2)增大反应物的接触面积,加快反应速率,提高浸取率 $SiO_{2}$
(3)$(NH_{4})_{2}SO_{4}$
(4)$BeO + Cl_{2}+C\xlongequal{600~800^{\circ}C}CO + BeCl_{2}$
(5)10
解析 绿柱石煅烧生成对应的氧化物($BeO$、$Al_{2}O_{3}$、$SiO_{2}$、$Fe_{2}O_{3}$),浓硫酸浸取时,$SiO_{2}$不反应;加硫酸铵调节$pH = 1.5$,加氨水调节$pH = 5.1$,$Fe^{3+}$、$Al^{3+}$被除去,再加入氨水到$pH = 8.0$生成$Be(OH)_{2}$沉淀,滤液硫酸铵循环利用。
(5)设$Be(OH)_{2}$的溶度积常数为$K_{sp}$,$K_{sp}=c(Be^{2+})\times c^{2}(OH^{-})$,$c(Be^{2+})=\frac{K_{sp}}{c^{2}(OH^{-})}$,当$pH = 8.0$时,$c(OH^{-}) = 10^{-6}mol/L$,铍损失浓度$c(Be^{2+})=\frac{K_{sp}}{10^{-12}}mol/L$;当$pH = 8.5$时,$c(OH^{-}) = 10^{-5.5}mol/L$,铍损失浓度$c(Be^{2+})=\frac{K_{sp}}{10^{-11}}mol/L$,损失降低至原来的10%。
知识拓展
绿柱石$(Be_{3}Al_{2}Si_{6}O_{18})$的成分可以写成$3BeO\cdot Al_{2}O_{3}\cdot 6SiO_{2}$,可认为其兼有三种氧化物的化学性质。

答案
(1)+2
(2)增大反应物的接触面积,加快反应速率,提高浸取率 $SiO_{2}$
(3)$(NH_{4})_{2}SO_{4}$
(4)$BeO + Cl_{2}+C\xlongequal{600~800^{\circ}C}CO + BeCl_{2}$
(5)10
解析 绿柱石煅烧生成对应的氧化物($BeO$、$Al_{2}O_{3}$、$SiO_{2}$、$Fe_{2}O_{3}$),浓硫酸浸取时,$SiO_{2}$不反应;加硫酸铵调节$pH = 1.5$,加氨水调节$pH = 5.1$,$Fe^{3+}$、$Al^{3+}$被除去,再加入氨水到$pH = 8.0$生成$Be(OH)_{2}$沉淀,滤液硫酸铵循环利用。
(5)设$Be(OH)_{2}$的溶度积常数为$K_{sp}$,$K_{sp}=c(Be^{2+})\times c^{2}(OH^{-})$,$c(Be^{2+})=\frac{K_{sp}}{c^{2}(OH^{-})}$,当$pH = 8.0$时,$c(OH^{-}) = 10^{-6}mol/L$,铍损失浓度$c(Be^{2+})=\frac{K_{sp}}{10^{-12}}mol/L$;当$pH = 8.5$时,$c(OH^{-}) = 10^{-5.5}mol/L$,铍损失浓度$c(Be^{2+})=\frac{K_{sp}}{10^{-11}}mol/L$,损失降低至原来的10%。
知识拓展
绿柱石$(Be_{3}Al_{2}Si_{6}O_{18})$的成分可以写成$3BeO\cdot Al_{2}O_{3}\cdot 6SiO_{2}$,可认为其兼有三种氧化物的化学性质。

查看更多完整答案,请扫码查看


