2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第97页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. [2025·安徽卷,14T,3 分]H₂A 是二元弱酸,M²⁺不发生水解。25℃时,向足量的难溶盐 MA 粉末中加入稀盐酸,平衡时溶液中 lg[c(M²⁺)/(mol·L⁻¹)]与 pH 的关系如下图所示。
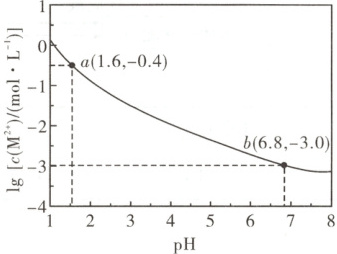
已知 25℃时,Kₐ₁(H₂A)=10⁻¹.⁶,Kₐ₂(H₂A)=10⁻⁶.⁸,lg2=0.3。下列说法正确的是(
A.25℃时,MA 的溶度积常数 Kₛₚ(MA)=10⁻⁶.³
B.pH=1.6 时,溶液中 c(M²⁺)>c(Cl⁻)>c(HA⁻)>c(A²⁻)
C.pH=4.5 时,溶液中 c(HA⁻)>c(H₂A)>c(A²⁻)
D.pH=6.8 时,溶液中 c(H⁺)+2c(HA⁻)+c(H₂A)=c(OH⁻)+c(Cl⁻)

已知 25℃时,Kₐ₁(H₂A)=10⁻¹.⁶,Kₐ₂(H₂A)=10⁻⁶.⁸,lg2=0.3。下列说法正确的是(
A
)A.25℃时,MA 的溶度积常数 Kₛₚ(MA)=10⁻⁶.³
B.pH=1.6 时,溶液中 c(M²⁺)>c(Cl⁻)>c(HA⁻)>c(A²⁻)
C.pH=4.5 时,溶液中 c(HA⁻)>c(H₂A)>c(A²⁻)
D.pH=6.8 时,溶液中 c(H⁺)+2c(HA⁻)+c(H₂A)=c(OH⁻)+c(Cl⁻)
答案:
7. 参考答案A
命题意图本题结合沉淀溶解平衡与弱酸电离平衡,考查溶度积计算、离子浓度大小比较,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路溶液中存在元素质量守恒$c{(M^{2+})} = c{(H_{2}A)} + c{(HA^{-})} + c{(A^{2-})}$,由图可知,当${pH} = 6.8$时,$c{(M^{2+})} = 10^{-3} \ mol· L^{-1}$,根据$K_{ a2}{(H_{2}A)} = \dfrac{c{(A^{2-})}· c{(H^{+})}}{c{(HA^{-})}} = 10^{-6.8}$,则此时有$c{(HA^{-})} = c{(A^{2-})}$,$c{(H_{2}A)}$很小,可忽略不计,近似有$c{(A^{2-})} = c{(HA^{-})} \approx \dfrac{1}{2}c{(M^{2+})} = \dfrac{1}{2} × 10^{-3} \ mol· L^{-1}$,则$K_{ sp}{(MA)} = c{(M^{2+})} · c{(A^{2-})} = 10^{-3} × \dfrac{1}{2} × 10^{-3} = \dfrac{1}{2} × 10^{-6}$,$\lg K_{ sp}{(MA)} = -6 - \lg 2 = -6.3$,则$K_{ sp}{(MA)} = 10^{-6.3}$,A项正确。${pH} = 1.6$时,根据$K_{ a1}{(H_{2}A)} = 10^{-1.6}$可知,此时溶液中$c{(H_{2}A)} = c{(HA^{-})}$,$c{(A^{2-})} = \dfrac{K_{ sp}{(MA)}}{c{(M^{2+})}} = 10^{-5.9} \ mol· L^{-1}$,${A^{2-}}$可忽略不计,则$c{(H_{2}A)} + c{(HA^{-})} = 2c{(HA^{-})} \approx c{(M^{2+})}$,$c{(HA^{-})} = 0.5 × 10^{-0.4} \ mol· L^{-1}$,结合电荷守恒可得$2c{(M^{2+})} + c{(H^{+})} = c{(HA^{-})} + 2c{(A^{2-})} + c{(Cl^{-})} + c{(OH^{-})}$,$1.5c{(M^{2+})} + c{(H^{+})} = 2c{(A^{2-})} + c{(Cl^{-})} + c{(OH^{-})}$,${A^{2-}}$很小可以忽略不计,溶液呈酸性,$c{(H^{+})} > c{(OH^{-})}$,则$c{(Cl^{-})} > 1.5c{(M^{2+})}$,故$c{(Cl^{-})} > c{(M^{2+})} > c{(HA^{-})} > c{(A^{2-})}$,B项错误。${pH} = 4.5$时,$c{(HA^{-})} = \dfrac{c{(H^{+})} · c{(A^{2-})}}{K_{ a2}} = \dfrac{10^{-4.5}c{(A^{2-})}}{10^{-6.8}} = 10^{2.3}c{(A^{2-})}$,$c{(H_{2}A)} = \dfrac{c^{2}{(H^{+})} · c{(A^{2-})}}{K_{ a1} · K_{ a2}} = \dfrac{(10^{-4.5})^{2}c{(A^{2-})}}{10^{-1.6} × 10^{-6.8}} = 10^{-0.6}c{(A^{2-})}$,可得$c{(HA^{-})} > c{(A^{2-})} > c{(H_{2}A)}$,C项错误。根据电荷守恒关系$c{(H^{+})} + 2c{(M^{2+})} = c{(Cl^{-})} + c{(HA^{-})} + 2c{(A^{2-})} + c{(OH^{-})}$和元素质量守恒关系$c{(M^{2+})} = c{(A^{2-})} + c{(HA^{-})} + c{(H_{2}A)}$,可得$c{(H^{+})} + 2c{(H_{2}A)} + c{(HA^{-})} = c{(Cl^{-})} + c{(OH^{-})}$,而${pH} = 6.8$时,$c{(HA^{-})} = c{(A^{2-})} \neq c{(H_{2}A)}$,等式不成立,D项错误。
思路分析
MA存在沉淀溶解平衡MA(s)$\rightleftharpoons$M²⁺(aq)+A²⁻(aq),向足量的难溶盐MA粉末中加入稀盐酸,发生反应MA+H⁺$\rightleftharpoons$M²⁺+HA⁻,继续加盐酸发生反应HA⁻+H⁺$\rightleftharpoons$H₂A。由$K_{a1}(H_{2}A)=\frac{c(HA^{-})· c(H^{+})}{c(H_{2}A)} = 10^{-1.6}$可知,当$c(H_{2}A)=c(HA^{-})$时,pH = 1.6;$K_{a2}(H_{2}A)=\frac{c(A^{2-})· c(H^{+})}{c(HA^{-})} = 10^{-6.8}$,当$c(A^{2-})=c(HA^{-})$时,pH = 6.8;$K_{a1}K_{a2}=\frac{c(A^{2-})· c^{2}(H^{+})}{c(H_{2}A)} = 10^{-8.4}$,当$c(A^{2-})=c(H_{2}A)$时,pH = 4.2。则可将图像转化为pH - δ(A)(含A粒子的分布分数)进行分析。

7. 参考答案A
命题意图本题结合沉淀溶解平衡与弱酸电离平衡,考查溶度积计算、离子浓度大小比较,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路溶液中存在元素质量守恒$c{(M^{2+})} = c{(H_{2}A)} + c{(HA^{-})} + c{(A^{2-})}$,由图可知,当${pH} = 6.8$时,$c{(M^{2+})} = 10^{-3} \ mol· L^{-1}$,根据$K_{ a2}{(H_{2}A)} = \dfrac{c{(A^{2-})}· c{(H^{+})}}{c{(HA^{-})}} = 10^{-6.8}$,则此时有$c{(HA^{-})} = c{(A^{2-})}$,$c{(H_{2}A)}$很小,可忽略不计,近似有$c{(A^{2-})} = c{(HA^{-})} \approx \dfrac{1}{2}c{(M^{2+})} = \dfrac{1}{2} × 10^{-3} \ mol· L^{-1}$,则$K_{ sp}{(MA)} = c{(M^{2+})} · c{(A^{2-})} = 10^{-3} × \dfrac{1}{2} × 10^{-3} = \dfrac{1}{2} × 10^{-6}$,$\lg K_{ sp}{(MA)} = -6 - \lg 2 = -6.3$,则$K_{ sp}{(MA)} = 10^{-6.3}$,A项正确。${pH} = 1.6$时,根据$K_{ a1}{(H_{2}A)} = 10^{-1.6}$可知,此时溶液中$c{(H_{2}A)} = c{(HA^{-})}$,$c{(A^{2-})} = \dfrac{K_{ sp}{(MA)}}{c{(M^{2+})}} = 10^{-5.9} \ mol· L^{-1}$,${A^{2-}}$可忽略不计,则$c{(H_{2}A)} + c{(HA^{-})} = 2c{(HA^{-})} \approx c{(M^{2+})}$,$c{(HA^{-})} = 0.5 × 10^{-0.4} \ mol· L^{-1}$,结合电荷守恒可得$2c{(M^{2+})} + c{(H^{+})} = c{(HA^{-})} + 2c{(A^{2-})} + c{(Cl^{-})} + c{(OH^{-})}$,$1.5c{(M^{2+})} + c{(H^{+})} = 2c{(A^{2-})} + c{(Cl^{-})} + c{(OH^{-})}$,${A^{2-}}$很小可以忽略不计,溶液呈酸性,$c{(H^{+})} > c{(OH^{-})}$,则$c{(Cl^{-})} > 1.5c{(M^{2+})}$,故$c{(Cl^{-})} > c{(M^{2+})} > c{(HA^{-})} > c{(A^{2-})}$,B项错误。${pH} = 4.5$时,$c{(HA^{-})} = \dfrac{c{(H^{+})} · c{(A^{2-})}}{K_{ a2}} = \dfrac{10^{-4.5}c{(A^{2-})}}{10^{-6.8}} = 10^{2.3}c{(A^{2-})}$,$c{(H_{2}A)} = \dfrac{c^{2}{(H^{+})} · c{(A^{2-})}}{K_{ a1} · K_{ a2}} = \dfrac{(10^{-4.5})^{2}c{(A^{2-})}}{10^{-1.6} × 10^{-6.8}} = 10^{-0.6}c{(A^{2-})}$,可得$c{(HA^{-})} > c{(A^{2-})} > c{(H_{2}A)}$,C项错误。根据电荷守恒关系$c{(H^{+})} + 2c{(M^{2+})} = c{(Cl^{-})} + c{(HA^{-})} + 2c{(A^{2-})} + c{(OH^{-})}$和元素质量守恒关系$c{(M^{2+})} = c{(A^{2-})} + c{(HA^{-})} + c{(H_{2}A)}$,可得$c{(H^{+})} + 2c{(H_{2}A)} + c{(HA^{-})} = c{(Cl^{-})} + c{(OH^{-})}$,而${pH} = 6.8$时,$c{(HA^{-})} = c{(A^{2-})} \neq c{(H_{2}A)}$,等式不成立,D项错误。
思路分析
MA存在沉淀溶解平衡MA(s)$\rightleftharpoons$M²⁺(aq)+A²⁻(aq),向足量的难溶盐MA粉末中加入稀盐酸,发生反应MA+H⁺$\rightleftharpoons$M²⁺+HA⁻,继续加盐酸发生反应HA⁻+H⁺$\rightleftharpoons$H₂A。由$K_{a1}(H_{2}A)=\frac{c(HA^{-})· c(H^{+})}{c(H_{2}A)} = 10^{-1.6}$可知,当$c(H_{2}A)=c(HA^{-})$时,pH = 1.6;$K_{a2}(H_{2}A)=\frac{c(A^{2-})· c(H^{+})}{c(HA^{-})} = 10^{-6.8}$,当$c(A^{2-})=c(HA^{-})$时,pH = 6.8;$K_{a1}K_{a2}=\frac{c(A^{2-})· c^{2}(H^{+})}{c(H_{2}A)} = 10^{-8.4}$,当$c(A^{2-})=c(H_{2}A)$时,pH = 4.2。则可将图像转化为pH - δ(A)(含A粒子的分布分数)进行分析。

8. [2025·甘肃卷,14T,3 分]氨基乙酸(NH₂CH₂COOH)是结构最简单的氨基酸分子,其分子在水溶液中存在如下平衡:
在 25℃时,其分布分数 δ[如$ δ(NH₂CH₂COO⁻)=\\(\frac{c(NH_{2}CH_{2}COO^{-})}{c(^{+}NH_{3}CH_{2}COOH)+c(^{+}NH_{3}CH_{2}COO^{-})+c(NH_{2}CH_{2}COO^{-})}\\)],$与溶液 pH 关系如右上图所示。在 100mL0.01mol·L⁻¹⁺NH₃CH₂COOH·Cl⁻溶液中逐滴滴入 0.1mol·L⁻¹NaOH 溶液,溶液 pH 与 NaOH 溶液滴入体积的变化关系如右下图所示。下列说法错误的是(
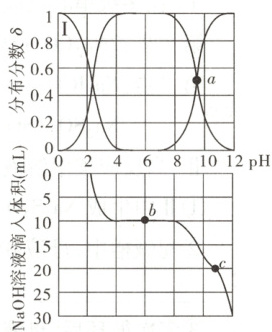
A.曲线Ⅰ对应的离子是⁺NH₃CH₂COOH
B.a 点处对应的 pH 为 9.6
C.b 点处 c(⁺NH₃CH₂COOH)=c(NH₂CH₂COO⁻)
D.c 点处 2c(⁺NH₃CH₂COOH)+c(⁺NH₃CH₂COO⁻)+c(H⁺)=c(OH⁻)
在 25℃时,其分布分数 δ[如$ δ(NH₂CH₂COO⁻)=\\(\frac{c(NH_{2}CH_{2}COO^{-})}{c(^{+}NH_{3}CH_{2}COOH)+c(^{+}NH_{3}CH_{2}COO^{-})+c(NH_{2}CH_{2}COO^{-})}\\)],$与溶液 pH 关系如右上图所示。在 100mL0.01mol·L⁻¹⁺NH₃CH₂COOH·Cl⁻溶液中逐滴滴入 0.1mol·L⁻¹NaOH 溶液,溶液 pH 与 NaOH 溶液滴入体积的变化关系如右下图所示。下列说法错误的是(
C
)
A.曲线Ⅰ对应的离子是⁺NH₃CH₂COOH
B.a 点处对应的 pH 为 9.6
C.b 点处 c(⁺NH₃CH₂COOH)=c(NH₂CH₂COO⁻)
D.c 点处 2c(⁺NH₃CH₂COOH)+c(⁺NH₃CH₂COO⁻)+c(H⁺)=c(OH⁻)
答案:
8. 参考答案C
命题意图本题以氨基乙酸在水溶液中平衡为情境,考查水溶液中的离子反应与平衡相关知识,掌握三大守恒关系为解题关键,意在考查考生从图中获取信息与解决问题的能力,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路随着${pH}$增大,平衡${^{+}NH_{3}CH_{2}COOH \underset{\lower{7mu}{}}{\overset{pK_{1}=2.4}{⇌}} ^{+}NH_{3}CH_{2}COO^{-} \underset{\lower{7mu}{}}{\overset{pK_{2}=9.6}{⇌}} NH_{2}CH_{2}COO^{-}}$右移,${^{+}NH_{3}CH_{2}COOH}$的分布分数减小,${^{+}NH_{3}CH_{2}COO^{-}}$的分布分数先增大后减小,${NH_{2}CH_{2}COO^{-}}$的分布分数增大,则曲线Ⅰ代表${^{+}NH_{3}CH_{2}COOH}$的分布分数,A项正确。$a$点代表${^{+}NH_{3}CH_{2}COO^{-}}$和${NH_{2}CH_{2}COO^{-}}$分布分数相等的点,即二者浓度相等,$pK_{2} = 9.6$,$K_{2} = \dfrac{c{(NH_{2}CH_{2}COO^{-})} · c{(H^{+})}}{c{(^{+}NH_{3}CH_{2}COO^{-})}} = c{(H^{+})} = 10^{-9.6}$,则$a$点处对应的${pH}$为$9.6$,B项正确。$b$点滴入$0.1 \ mol· L^{-1} \ {NaOH}$溶液为$10 \ mL$,${^{+}NH_{3}CH_{2}COOH· Cl^{-}}$和${NaOH}$的物质的量相等,得到的溶液中的溶质为等浓度的${^{+}NH_{3}CH_{2}COO^{-}}$和${NaCl}$,${^{+}NH_{3}CH_{2}COO^{-}}$在溶液中存在电离和水解,$K_{2} = 10^{-9.6}$,$K_{ h} = \dfrac{K_{ w}}{K_{1}} = \dfrac{10^{-14}}{10^{-2.4}} = 10^{-11.6} < K_{2}$,即电离程度大于水解程度,则$c{(^{+}NH_{3}CH_{2}COOH)} < c{(NH_{2}CH_{2}COO^{-})}$,C项错误。$c$点${^{+}NH_{3}CH_{2}COOH· Cl^{-}}$和${NaOH}$的物质的量之比为$1:2$,此时溶液中的溶质为等浓度的${NH_{2}CH_{2}COONa}$和${NaCl}$,根据质子守恒,有$2c{(^{+}NH_{3}CH_{2}COOH) + c(^{+}NH_{3}CH_{2}COO^{-}) + c(H^{+}) = c(OH^{-})}$,D项正确。
命题意图本题以氨基乙酸在水溶液中平衡为情境,考查水溶液中的离子反应与平衡相关知识,掌握三大守恒关系为解题关键,意在考查考生从图中获取信息与解决问题的能力,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路随着${pH}$增大,平衡${^{+}NH_{3}CH_{2}COOH \underset{\lower{7mu}{}}{\overset{pK_{1}=2.4}{⇌}} ^{+}NH_{3}CH_{2}COO^{-} \underset{\lower{7mu}{}}{\overset{pK_{2}=9.6}{⇌}} NH_{2}CH_{2}COO^{-}}$右移,${^{+}NH_{3}CH_{2}COOH}$的分布分数减小,${^{+}NH_{3}CH_{2}COO^{-}}$的分布分数先增大后减小,${NH_{2}CH_{2}COO^{-}}$的分布分数增大,则曲线Ⅰ代表${^{+}NH_{3}CH_{2}COOH}$的分布分数,A项正确。$a$点代表${^{+}NH_{3}CH_{2}COO^{-}}$和${NH_{2}CH_{2}COO^{-}}$分布分数相等的点,即二者浓度相等,$pK_{2} = 9.6$,$K_{2} = \dfrac{c{(NH_{2}CH_{2}COO^{-})} · c{(H^{+})}}{c{(^{+}NH_{3}CH_{2}COO^{-})}} = c{(H^{+})} = 10^{-9.6}$,则$a$点处对应的${pH}$为$9.6$,B项正确。$b$点滴入$0.1 \ mol· L^{-1} \ {NaOH}$溶液为$10 \ mL$,${^{+}NH_{3}CH_{2}COOH· Cl^{-}}$和${NaOH}$的物质的量相等,得到的溶液中的溶质为等浓度的${^{+}NH_{3}CH_{2}COO^{-}}$和${NaCl}$,${^{+}NH_{3}CH_{2}COO^{-}}$在溶液中存在电离和水解,$K_{2} = 10^{-9.6}$,$K_{ h} = \dfrac{K_{ w}}{K_{1}} = \dfrac{10^{-14}}{10^{-2.4}} = 10^{-11.6} < K_{2}$,即电离程度大于水解程度,则$c{(^{+}NH_{3}CH_{2}COOH)} < c{(NH_{2}CH_{2}COO^{-})}$,C项错误。$c$点${^{+}NH_{3}CH_{2}COOH· Cl^{-}}$和${NaOH}$的物质的量之比为$1:2$,此时溶液中的溶质为等浓度的${NH_{2}CH_{2}COONa}$和${NaCl}$,根据质子守恒,有$2c{(^{+}NH_{3}CH_{2}COOH) + c(^{+}NH_{3}CH_{2}COO^{-}) + c(H^{+}) = c(OH^{-})}$,D项正确。
9. [2025·辽宁卷,15T,3 分]室温下,将 0.1molAgCl 置于 0.1mol·L⁻¹NH₄NO₃溶液中,保持溶液体积和 N 元素总物质的量不变,pX - pH 曲线如图,Ag⁺+NH₃⇌[Ag(NH₃)]⁺和 Ag⁺+2NH₃⇌[Ag(NH₃)₂]⁺的平衡常数分别为 K₁和 K₂;NH₄⁺的水解常数 Kₕ(NH₄⁺)=10⁻⁹.²⁵。
下列说法错误的是(
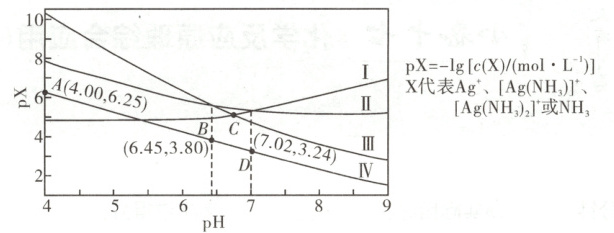
A.Ⅲ为[Ag(NH₃)₂]⁺的变化曲线
B.D 点:c(NH₄⁺)-c(OH⁻)>0.1 - c(H⁺)
C.K₁=10³.²⁴
D.C 点:c(NH₃)=10⁻³.⁵²mol·L⁻¹
下列说法错误的是(
B
)
A.Ⅲ为[Ag(NH₃)₂]⁺的变化曲线
B.D 点:c(NH₄⁺)-c(OH⁻)>0.1 - c(H⁺)
C.K₁=10³.²⁴
D.C 点:c(NH₃)=10⁻³.⁵²mol·L⁻¹
答案:
9. 参考答案B
命题意图本题考查水溶液中的离子反应与平衡,意在考查考生的读图能力和分析推理能力,体现了“证据推理与模型认知”“变化观念与平衡思想”等化学学科核心素养。
解题思路${NH^{+}_{4}}$在水溶液中会发生水解,${NH^{+}_{4} + H_{2}O⇌ NH_{3}· H_{2}O + H^{+}}$,${NH_{3}· H_{2}O⇌ NH_{3} + H_{2}O}$,随溶液的${pH}$的增大,${NH^{+}_{4}}$的水解平衡正向移动,${NH_{3}}$浓度增大,$p{NH_{3}}$减小,结合$K_{ h}{(NH^{+}_{4})} = 10^{-9.25}$和${A}$点坐标,则Ⅳ为${NH_{3}}$的变化曲线。${NH_{3}}$浓度增大,使${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$浓度增大,${Ag^{+}}$浓度减小,则$p{[Ag(NH_{3})]^{+}}$、$p{[Ag(NH_{3})_{2}]^{+}}$减小,$p{Ag^{+}}$增大。当初始${pH}$较小时,$c{(NH_{3})}$较小,$c{([Ag(NH_{3})]^{+})} > c{([Ag(NH_{3})_{2}]^{+})}$,则$p{[Ag(NH_{3})]^{+}}$小于$p{[Ag(NH_{3})_{2}]^{+}}$,故曲线Ⅰ、Ⅱ、Ⅲ分别代表${Ag^{+}}$、${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$的变化曲线,A项正确。${NH^{+}_{4}}$在水溶液中会发生水解,$c{(NH^{+}_{4})} < 0.1 \ mol· L^{-1}$,${D}$点时溶液${pH} = 7.02$,显碱性,即$c{(OH^{-})} > c{(H^{+})}$,故$c{(NH^{+}_{4})} - c{(OH^{-})} < 0.1 - c{(H^{+})}$,B项错误。根据图像可知,${D}$点时$c{([Ag(NH_{3})]^{+})} = c{(Ag^{+})}$,此时$c{(NH_{3})} = 10^{-3.24} \ mol· L^{-1}$,则$K_{1} = \dfrac{c{([Ag(NH_{3})]^{+})}}{c{(Ag^{+})} · c{(NH_{3})}} = 10^{3.24}$,C项正确。${B}$点时,$c{([Ag(NH_{3})_{2}]^{+})} = c{([Ag(NH_{3})]^{+})}$,$c{(NH_{3})} = 10^{-3.80} \ mol· L^{-1}$,所以反应${[Ag(NH_{3})]^{+} + NH_{3}⇌ [Ag(NH_{3})_{2}]^{+}}$的平衡常数为$10^{3.80}$,则$K_{2} = 10^{3.24} × 10^{3.80} = 10^{7.04}$,${C}$点时,$c{([Ag(NH_{3})_{2}]^{+})} = c{(Ag^{+})}$,所以$c{(NH_{3})} = \sqrt{\dfrac{10^{-7.04}}{10^{3.24}}} \ mol· L^{-1} = 10^{-5.12} \ mol· L^{-1}$,D项正确。
命题意图本题考查水溶液中的离子反应与平衡,意在考查考生的读图能力和分析推理能力,体现了“证据推理与模型认知”“变化观念与平衡思想”等化学学科核心素养。
解题思路${NH^{+}_{4}}$在水溶液中会发生水解,${NH^{+}_{4} + H_{2}O⇌ NH_{3}· H_{2}O + H^{+}}$,${NH_{3}· H_{2}O⇌ NH_{3} + H_{2}O}$,随溶液的${pH}$的增大,${NH^{+}_{4}}$的水解平衡正向移动,${NH_{3}}$浓度增大,$p{NH_{3}}$减小,结合$K_{ h}{(NH^{+}_{4})} = 10^{-9.25}$和${A}$点坐标,则Ⅳ为${NH_{3}}$的变化曲线。${NH_{3}}$浓度增大,使${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$浓度增大,${Ag^{+}}$浓度减小,则$p{[Ag(NH_{3})]^{+}}$、$p{[Ag(NH_{3})_{2}]^{+}}$减小,$p{Ag^{+}}$增大。当初始${pH}$较小时,$c{(NH_{3})}$较小,$c{([Ag(NH_{3})]^{+})} > c{([Ag(NH_{3})_{2}]^{+})}$,则$p{[Ag(NH_{3})]^{+}}$小于$p{[Ag(NH_{3})_{2}]^{+}}$,故曲线Ⅰ、Ⅱ、Ⅲ分别代表${Ag^{+}}$、${[Ag(NH_{3})]^{+}}$、${[Ag(NH_{3})_{2}]^{+}}$的变化曲线,A项正确。${NH^{+}_{4}}$在水溶液中会发生水解,$c{(NH^{+}_{4})} < 0.1 \ mol· L^{-1}$,${D}$点时溶液${pH} = 7.02$,显碱性,即$c{(OH^{-})} > c{(H^{+})}$,故$c{(NH^{+}_{4})} - c{(OH^{-})} < 0.1 - c{(H^{+})}$,B项错误。根据图像可知,${D}$点时$c{([Ag(NH_{3})]^{+})} = c{(Ag^{+})}$,此时$c{(NH_{3})} = 10^{-3.24} \ mol· L^{-1}$,则$K_{1} = \dfrac{c{([Ag(NH_{3})]^{+})}}{c{(Ag^{+})} · c{(NH_{3})}} = 10^{3.24}$,C项正确。${B}$点时,$c{([Ag(NH_{3})_{2}]^{+})} = c{([Ag(NH_{3})]^{+})}$,$c{(NH_{3})} = 10^{-3.80} \ mol· L^{-1}$,所以反应${[Ag(NH_{3})]^{+} + NH_{3}⇌ [Ag(NH_{3})_{2}]^{+}}$的平衡常数为$10^{3.80}$,则$K_{2} = 10^{3.24} × 10^{3.80} = 10^{7.04}$,${C}$点时,$c{([Ag(NH_{3})_{2}]^{+})} = c{(Ag^{+})}$,所以$c{(NH_{3})} = \sqrt{\dfrac{10^{-7.04}}{10^{3.24}}} \ mol· L^{-1} = 10^{-5.12} \ mol· L^{-1}$,D项正确。
查看更多完整答案,请扫码查看


