2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. [2024·安徽卷,6T,3分]$ N_{A} $ 是阿伏加德罗常数的值。下列说法正确的是 (
A.标准状况下,2.24 L X 和 Y 混合气体中氧原子数为 $ 0.1N_{A} $
B.1 L 0.1 mol·L⁻¹ $ NaNO_{2} $ 溶液中 $ Na^{+} $ 和 $ NO_{2}^{-} $ 数均为 $ 0.1N_{A} $
C.3.3 g $ NH_{2}OH $ 完全转化为 $ NO_{2}^{-} $ 时,转移的电子数为 $ 0.6N_{A} $
D.2.8 g $ N_{2} $ 中含有的价电子总数为 $ 0.6N_{A} $
A
)A.标准状况下,2.24 L X 和 Y 混合气体中氧原子数为 $ 0.1N_{A} $
B.1 L 0.1 mol·L⁻¹ $ NaNO_{2} $ 溶液中 $ Na^{+} $ 和 $ NO_{2}^{-} $ 数均为 $ 0.1N_{A} $
C.3.3 g $ NH_{2}OH $ 完全转化为 $ NO_{2}^{-} $ 时,转移的电子数为 $ 0.6N_{A} $
D.2.8 g $ N_{2} $ 中含有的价电子总数为 $ 0.6N_{A} $
答案:
7. 参考答案 A
命题意图 本题考查阿伏加德罗常数,涉及微粒数目、氧化还原反应等知识,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 ${NO^{-}_{2}}$在亚硝酸盐还原酶的作用下转化为X,X在X还原酶的作用下转化为Y,X、Y均为氮氧化物,即X为${NO}$,Y为${N_{2}O}$。标准状况下,2.24 L ${NO}$和${N_{2}O}$混合气体物质的量为0.1 mol,氧原子数为$0.1N_{ A}$,A项正确。${NO^{-}_{2}}$在水溶液中会发生水解,1 L $0.1\ mol· L^{-1}$ ${NaNO_{2}}$溶液中${NO^{-}_{2}}$数小于$0.1N_{ A}$,B项错误。${NH_{2}OH}$完全转化为${NO^{-}_{2}}$时,N元素的化合价由-1升高到+3,3.3 g ${NH_{2}OH}$物质的量为0.1 mol,转移的电子数为$0.4N_{ A}$,C项错误。2.8 g ${N_{2}}$物质的量为0.1 mol,N的价电子数为5,则2.8 g ${N_{2}}$中含有的价电子总数为$N_{ A}$,D项错误。
命题意图 本题考查阿伏加德罗常数,涉及微粒数目、氧化还原反应等知识,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 ${NO^{-}_{2}}$在亚硝酸盐还原酶的作用下转化为X,X在X还原酶的作用下转化为Y,X、Y均为氮氧化物,即X为${NO}$,Y为${N_{2}O}$。标准状况下,2.24 L ${NO}$和${N_{2}O}$混合气体物质的量为0.1 mol,氧原子数为$0.1N_{ A}$,A项正确。${NO^{-}_{2}}$在水溶液中会发生水解,1 L $0.1\ mol· L^{-1}$ ${NaNO_{2}}$溶液中${NO^{-}_{2}}$数小于$0.1N_{ A}$,B项错误。${NH_{2}OH}$完全转化为${NO^{-}_{2}}$时,N元素的化合价由-1升高到+3,3.3 g ${NH_{2}OH}$物质的量为0.1 mol,转移的电子数为$0.4N_{ A}$,C项错误。2.8 g ${N_{2}}$物质的量为0.1 mol,N的价电子数为5,则2.8 g ${N_{2}}$中含有的价电子总数为$N_{ A}$,D项错误。
8. [2024·江西卷,7T,3分]我国学者把游离态氮固定在碳上(示踪反应如下),制得的$ [N\xlongequal{}C\xlongequal{}N]^{2-} $离子可用于合成核酸的结构单元。阿伏加德罗常数的值为 $ N_{A} $,下列说法正确的是 (
$ ^{15}N_{2}+C_{(石墨)}+2LiH\xrightarrow{20atm,550^{\circ}C,5h}Li_{2}[^{15}NC^{15}N]+H_{2} $
A.22.4 L $ ^{15}N_{2} $ 含有的中子数为 $ 16N_{A} $
B.12 g $ C_{(石墨)} $ 中 $ sp^{2} $ 杂化轨道含有的电子数为 $ 6N_{A} $
C.1 mol $ [N\xlongequal{}C\xlongequal{}N]^{2-} $ 中含有的 $ \pi $ 键数为 $ 4N_{A} $
D.生成 1 mol $ H_{2} $ 时,总反应转移的电子数为 $ 6N_{A} $
D
)$ ^{15}N_{2}+C_{(石墨)}+2LiH\xrightarrow{20atm,550^{\circ}C,5h}Li_{2}[^{15}NC^{15}N]+H_{2} $
A.22.4 L $ ^{15}N_{2} $ 含有的中子数为 $ 16N_{A} $
B.12 g $ C_{(石墨)} $ 中 $ sp^{2} $ 杂化轨道含有的电子数为 $ 6N_{A} $
C.1 mol $ [N\xlongequal{}C\xlongequal{}N]^{2-} $ 中含有的 $ \pi $ 键数为 $ 4N_{A} $
D.生成 1 mol $ H_{2} $ 时,总反应转移的电子数为 $ 6N_{A} $
答案:
8. 参考答案 D
命题意图 本题以把游离态氮固定在碳上的反应为素材,考查阿伏加德罗常数,涉及微粒数目、化学键、氧化还原反应等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路 气体所处的温度压强未知,不能计算22.4 L ${^{15}N_{2}}$的物质的量,A项错误。12 g ${C_{(石墨)}}$物质的量为$\dfrac{12\ g}{12\ g· mol^{-1}} = 1\ mol$,每个C原子均采取$ sp^{2}$杂化,形成的3个$ sp^{2}$杂化中各有1个电子,$ sp^{2}$杂化轨道含有的电子数为$3N_{ A}$,B项错误。双键中含1个$\sigma$键和1个$\pi$键,1 mol ${[N=C=N]^{2-}}$中含有的$\pi$键数为$2N_{ A}$,C项错误。根据${^{15}N_{2} + C_{(石墨)} + 2LiH\xlongequal[5\ h]{20\ atm,550\ ^{\circ} C} Li_{2}[^{15} NC^{15} N] + H_{2}}$(反应中电子转移情况:${^{15}N_{2}}$得$2 × 3 e^{-}$,${LiH}$失$2 × 1 e^{-}$,${C_{(石墨)}}$失$1 × 4 e^{-}$)可知,${H_{2}\sim 6e^{-}}$,则生成1 mol ${H_{2}}$时,总反应转移的电子数为$6N_{ A}$,D项正确。
命题意图 本题以把游离态氮固定在碳上的反应为素材,考查阿伏加德罗常数,涉及微粒数目、化学键、氧化还原反应等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路 气体所处的温度压强未知,不能计算22.4 L ${^{15}N_{2}}$的物质的量,A项错误。12 g ${C_{(石墨)}}$物质的量为$\dfrac{12\ g}{12\ g· mol^{-1}} = 1\ mol$,每个C原子均采取$ sp^{2}$杂化,形成的3个$ sp^{2}$杂化中各有1个电子,$ sp^{2}$杂化轨道含有的电子数为$3N_{ A}$,B项错误。双键中含1个$\sigma$键和1个$\pi$键,1 mol ${[N=C=N]^{2-}}$中含有的$\pi$键数为$2N_{ A}$,C项错误。根据${^{15}N_{2} + C_{(石墨)} + 2LiH\xlongequal[5\ h]{20\ atm,550\ ^{\circ} C} Li_{2}[^{15} NC^{15} N] + H_{2}}$(反应中电子转移情况:${^{15}N_{2}}$得$2 × 3 e^{-}$,${LiH}$失$2 × 1 e^{-}$,${C_{(石墨)}}$失$1 × 4 e^{-}$)可知,${H_{2}\sim 6e^{-}}$,则生成1 mol ${H_{2}}$时,总反应转移的电子数为$6N_{ A}$,D项正确。
9. [2024·福建卷,6T,4分]我国科学家预测了稳定的氮单质分子 $ N_{8} $(结构如图)。设 $ N_{A} $ 为阿伏加德罗常数的值。下列说法错误的是 (
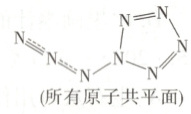
A.1.0 mol $ N_{8} $ 的 $ \sigma $ 键电子数为 $ 16N_{A} $
B.1.0 mol $ N_{8} $ 的(价层)孤电子对数为 $ 7N_{A} $
C.1.0 mol $ N_{8} $ 的 $ sp^{2} $ 杂化 N 原子数为 $ 6N_{A} $
D.112.0 g $ N_{8} $ 完全分解,产生的 $ N_{2} $ 分子数为 $ 4N_{A} $
B
)
A.1.0 mol $ N_{8} $ 的 $ \sigma $ 键电子数为 $ 16N_{A} $
B.1.0 mol $ N_{8} $ 的(价层)孤电子对数为 $ 7N_{A} $
C.1.0 mol $ N_{8} $ 的 $ sp^{2} $ 杂化 N 原子数为 $ 6N_{A} $
D.112.0 g $ N_{8} $ 完全分解,产生的 $ N_{2} $ 分子数为 $ 4N_{A} $
答案:
9. 参考答案 B
命题意图 本题以我国科学家预测的稳定氮单质分子${N_{8}}$的结构为情境,侧重考查考生的理解与辨析能力、分析与推理能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路 如图 ,根据${N_{8}}$分子中所有原子共平面,可以判断1~6号N原子为$ sp^{2}$杂化,7~8号N原子为$ sp$杂化。每2个邻接N原子间有1个$\sigma$键,共有8个$\sigma$键,则1.0 mol ${N_{8}}$的$\sigma$键电子数为$16N_{ A}$,A项正确。1号N原子未参与杂化的p轨道中的1对电子参与形成大$\pi$键,7号N原子的1对电子参与形成大$\pi$键,2、3、4、5、6、8号N原子的价层各有一个孤电子对,即单个分子共有6个孤电子对,B项错误。1~6号6个N原子均为$ sp^{2}$杂化,C项正确。${N_{8}}$完全分解的化学方程式为${N_{8} = 4N_{2}}$,112.0 g ${N_{8}}$的物质的量为1 mol,完全分解生成4 mol ${N_{2}}$,D项正确。
,根据${N_{8}}$分子中所有原子共平面,可以判断1~6号N原子为$ sp^{2}$杂化,7~8号N原子为$ sp$杂化。每2个邻接N原子间有1个$\sigma$键,共有8个$\sigma$键,则1.0 mol ${N_{8}}$的$\sigma$键电子数为$16N_{ A}$,A项正确。1号N原子未参与杂化的p轨道中的1对电子参与形成大$\pi$键,7号N原子的1对电子参与形成大$\pi$键,2、3、4、5、6、8号N原子的价层各有一个孤电子对,即单个分子共有6个孤电子对,B项错误。1~6号6个N原子均为$ sp^{2}$杂化,C项正确。${N_{8}}$完全分解的化学方程式为${N_{8} = 4N_{2}}$,112.0 g ${N_{8}}$的物质的量为1 mol,完全分解生成4 mol ${N_{2}}$,D项正确。
9. 参考答案 B
命题意图 本题以我国科学家预测的稳定氮单质分子${N_{8}}$的结构为情境,侧重考查考生的理解与辨析能力、分析与推理能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路 如图
 ,根据${N_{8}}$分子中所有原子共平面,可以判断1~6号N原子为$ sp^{2}$杂化,7~8号N原子为$ sp$杂化。每2个邻接N原子间有1个$\sigma$键,共有8个$\sigma$键,则1.0 mol ${N_{8}}$的$\sigma$键电子数为$16N_{ A}$,A项正确。1号N原子未参与杂化的p轨道中的1对电子参与形成大$\pi$键,7号N原子的1对电子参与形成大$\pi$键,2、3、4、5、6、8号N原子的价层各有一个孤电子对,即单个分子共有6个孤电子对,B项错误。1~6号6个N原子均为$ sp^{2}$杂化,C项正确。${N_{8}}$完全分解的化学方程式为${N_{8} = 4N_{2}}$,112.0 g ${N_{8}}$的物质的量为1 mol,完全分解生成4 mol ${N_{2}}$,D项正确。
,根据${N_{8}}$分子中所有原子共平面,可以判断1~6号N原子为$ sp^{2}$杂化,7~8号N原子为$ sp$杂化。每2个邻接N原子间有1个$\sigma$键,共有8个$\sigma$键,则1.0 mol ${N_{8}}$的$\sigma$键电子数为$16N_{ A}$,A项正确。1号N原子未参与杂化的p轨道中的1对电子参与形成大$\pi$键,7号N原子的1对电子参与形成大$\pi$键,2、3、4、5、6、8号N原子的价层各有一个孤电子对,即单个分子共有6个孤电子对,B项错误。1~6号6个N原子均为$ sp^{2}$杂化,C项正确。${N_{8}}$完全分解的化学方程式为${N_{8} = 4N_{2}}$,112.0 g ${N_{8}}$的物质的量为1 mol,完全分解生成4 mol ${N_{2}}$,D项正确。 10. [2024·广西卷,12T,3分]实验小组用如下流程探究含氮化合物的转化。$ N_{A} $ 为阿伏加德罗常数的值,下列说法正确的是 (

A.“反应 1”中,每消耗 0.1 mol $ NH_{4}Cl $,在 $ 25^{\circ}C $、101 kPa 下得到 2.24 L $ NH_{3} $
B.“反应 2”中,每生成 0.1 mol NO,转移电子数为 $ 0.5N_{A} $
C.在密闭容器中进行“反应 3”,0.1 mol NO 充分反应后体系中有 $ 0.1N_{A} $ 个 $ NO_{2} $
D.“反应 4”中,为使 0.1 mol $ NO_{2} $ 完全转化成 $ HNO_{3} $,至少需要 $ 0.02N_{A} $ 个 $ O_{2} $
B
)
A.“反应 1”中,每消耗 0.1 mol $ NH_{4}Cl $,在 $ 25^{\circ}C $、101 kPa 下得到 2.24 L $ NH_{3} $
B.“反应 2”中,每生成 0.1 mol NO,转移电子数为 $ 0.5N_{A} $
C.在密闭容器中进行“反应 3”,0.1 mol NO 充分反应后体系中有 $ 0.1N_{A} $ 个 $ NO_{2} $
D.“反应 4”中,为使 0.1 mol $ NO_{2} $ 完全转化成 $ HNO_{3} $,至少需要 $ 0.02N_{A} $ 个 $ O_{2} $
答案:
10. 参考答案 B
命题意图 本题以含氮化合物的转化为情境,考查阿伏加德罗常数相关知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路 “反应1”为实验室制备氨气的反应,化学方程式为${2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\Delta} 2NH_{3}\uparrow + CaCl_{2} + 2H_{2}O}$,“反应2”是氨气的催化氧化,化学方程式为${4NH_{3} + 5O_{2}\xlongequal[\Delta]{ 催化剂} 4NO + 6H_{2}O}$,“反应3”为${2NO + O_{2} = 2NO_{2}}$,“反应4”为${4NO_{2} + 2H_{2}O + O_{2} = 4HNO_{3}}$。“反应1”中每消耗0.1 mol ${NH_{4}Cl}$,生成0.1 mol ${NH_{3}}$,但是由于$25\ ^{\circ} C$、101 kPa不是标准状况,则气体体积不是2.24 L,A项错误。“反应2”中有${4NH_{3}\sim 4NO\sim 20e^{-}}$,则每生成0.1 mol ${NO}$,转移电子数为$0.5N_{ A}$,B项正确。根据“反应3”可知,0.1 mol ${NO}$充分反应后生成0.1 mol ${NO_{2}}$,但是体系中存在反应${2NO_{2}⇌ N_{2}O_{4}}$,则最终${NO_{2}}$数目小于$0.1N_{ A}$,C项错误。根据“反应4”可知,为使0.1 mol ${NO_{2}}$完全转化成${HNO_{3}}$,至少需要0.025 mol ${O_{2}}$,即$0.025N_{ A}$个${O_{2}}$,D项错误。
命题意图 本题以含氮化合物的转化为情境,考查阿伏加德罗常数相关知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路 “反应1”为实验室制备氨气的反应,化学方程式为${2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\Delta} 2NH_{3}\uparrow + CaCl_{2} + 2H_{2}O}$,“反应2”是氨气的催化氧化,化学方程式为${4NH_{3} + 5O_{2}\xlongequal[\Delta]{ 催化剂} 4NO + 6H_{2}O}$,“反应3”为${2NO + O_{2} = 2NO_{2}}$,“反应4”为${4NO_{2} + 2H_{2}O + O_{2} = 4HNO_{3}}$。“反应1”中每消耗0.1 mol ${NH_{4}Cl}$,生成0.1 mol ${NH_{3}}$,但是由于$25\ ^{\circ} C$、101 kPa不是标准状况,则气体体积不是2.24 L,A项错误。“反应2”中有${4NH_{3}\sim 4NO\sim 20e^{-}}$,则每生成0.1 mol ${NO}$,转移电子数为$0.5N_{ A}$,B项正确。根据“反应3”可知,0.1 mol ${NO}$充分反应后生成0.1 mol ${NO_{2}}$,但是体系中存在反应${2NO_{2}⇌ N_{2}O_{4}}$,则最终${NO_{2}}$数目小于$0.1N_{ A}$,C项错误。根据“反应4”可知,为使0.1 mol ${NO_{2}}$完全转化成${HNO_{3}}$,至少需要0.025 mol ${O_{2}}$,即$0.025N_{ A}$个${O_{2}}$,D项错误。
查看更多完整答案,请扫码查看


