2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第20页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
13.我国科学家发明了一种以 和MnO2为电极材料的新型电池,其内部结构如图所
和MnO2为电极材料的新型电池,其内部结构如图所
示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料 转化为
转化为 ,下列说法错误的是
,下列说法错误的是
(
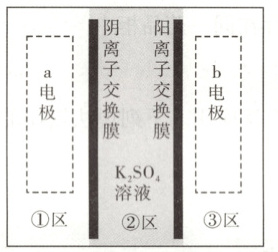
A.充电时,b电极上发生还原反应
B.充电时,外电源的正极连接b电极
C.放电时,①区溶液中的SO;向②区迁移
D.放电时,a电极的电极反应式为MnO2+4H++2e"一Mn2++2H20
 和MnO2为电极材料的新型电池,其内部结构如图所
和MnO2为电极材料的新型电池,其内部结构如图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
 转化为
转化为 ,下列说法错误的是
,下列说法错误的是(
B
)
A.充电时,b电极上发生还原反应
B.充电时,外电源的正极连接b电极
C.放电时,①区溶液中的SO;向②区迁移
D.放电时,a电极的电极反应式为MnO2+4H++2e"一Mn2++2H20
答案:
13. 参考答案 B
命题意图 本题考查新型二次电池,涉及电极反应、离子的迁移方向等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 电池放电时,聚合物电极材料由${KO- -OK}$转化为${O- -O}$,同时失去2个$ K^+$和2个电子,该反应为氧化反应,聚合物为电池的负极,结合②区电解质溶液为$ K_2 SO_4$,右侧为阳离子交换膜可知,${KO- -OK}$放电时,$ K^+$向正极移动,${O- -O}$充电时,$ K^+$向负极移动。
电池放电时,负极反应为${KO- -OK - 2e^- = O- -O + 2K^+}$,正极反应为$ MnO_2+4 H^++2 e^-= Mn^{2+}+2 H_2 O$;充电时,阴极反应为${O- -O + 2e^- + 2K^+ = KO- -OK}$,阳极反应为$ Mn^{2+}+2 H_2 O-2 e^-= MnO_2+4 H^+$。
A项:充电时,b电极连接电源负极,是阴极,发生还原反应,A项正确。
B项:充电时,外电源的负极连接b电极,B项错误。
C项:放电时,阴离子向负极移动,则①区溶液中的$ SO_4^{2-}$向②区迁移,C项正确。
D项:放电时,a电极为电源的正极,该电极的电极反应式为$ MnO_2+4 H^++2 e^-= Mn^{2+}+2 H_2 O$,D项正确。
命题意图 本题考查新型二次电池,涉及电极反应、离子的迁移方向等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 电池放电时,聚合物电极材料由${KO- -OK}$转化为${O- -O}$,同时失去2个$ K^+$和2个电子,该反应为氧化反应,聚合物为电池的负极,结合②区电解质溶液为$ K_2 SO_4$,右侧为阳离子交换膜可知,${KO- -OK}$放电时,$ K^+$向正极移动,${O- -O}$充电时,$ K^+$向负极移动。
电池放电时,负极反应为${KO- -OK - 2e^- = O- -O + 2K^+}$,正极反应为$ MnO_2+4 H^++2 e^-= Mn^{2+}+2 H_2 O$;充电时,阴极反应为${O- -O + 2e^- + 2K^+ = KO- -OK}$,阳极反应为$ Mn^{2+}+2 H_2 O-2 e^-= MnO_2+4 H^+$。
A项:充电时,b电极连接电源负极,是阴极,发生还原反应,A项正确。
B项:充电时,外电源的负极连接b电极,B项错误。
C项:放电时,阴离子向负极移动,则①区溶液中的$ SO_4^{2-}$向②区迁移,C项正确。
D项:放电时,a电极为电源的正极,该电极的电极反应式为$ MnO_2+4 H^++2 e^-= Mn^{2+}+2 H_2 O$,D项正确。
14.某温度下,两种难溶盐AgX、Ag,Y的饱和溶液中−lgc(X)或−lgc(Y")与−lgc(Ag")的关系如图
所示。下列说法错误的是 (
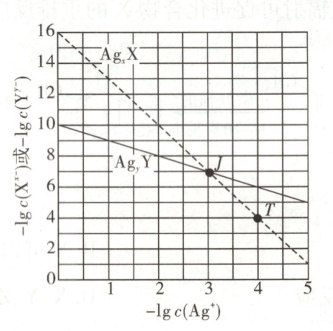
A.x:y=3:1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时$\frac{c(X−)}{c(Y"−)}$变小
C.向AgX固体中加入Na,Y溶液,可发生AgX→Ag,Y的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(X)+c(Y")<2c(Ag")
所示。下列说法错误的是 (
D
)
A.x:y=3:1
B.若混合溶液中各离子浓度如J点所示,加入AgNO3(s),则平衡时$\frac{c(X−)}{c(Y"−)}$变小
C.向AgX固体中加入Na,Y溶液,可发生AgX→Ag,Y的转化
D.若混合溶液中各离子起始浓度如T点所示,待平衡时c(X)+c(Y")<2c(Ag")
答案:
14. 参考答案 D
命题意图 本题考查难溶电解质的沉淀溶解平衡,掌握特殊点的意义是解题关键,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题思路 对于盐$ A_m B_n$,其溶度积$K_{ sp}( A_m B_n)=c^m( A^{n+})· c^n( B^{m-})$,$-\lg K_{ sp}( A_m B_n)=-m\lg c( A^{n+})-n\lg c( B^{m-})$。由图可知,曲线的斜率分别为$-x$和$-y$。$ Ag_3 X$曲线斜率为-3,即$x=3$,同理可知$y=1$,则$x:y=3:1$,A项正确。由图可知,若混合溶液中各离子浓度如J点所示,此时$\frac{c( X^{3-})}{c( Y^-)}=1$,加入$ AgNO_3( s)$,$c( Ag^+)$增大,$-\lg c( Ag^+)$减小,从图中看即向左移动,$c( X^{3-})$、$c( Y^-)$均减小,但$-\lg c( X^{3-})>-\lg c( Y^-)$,即$c( X^{3-})<c( Y^-)$,则$\frac{c( X^{3-})}{c( Y^-)}$变小,B项正确。由图可知,$K_{ sp}( Ag_3 X)=10^{-16}$,$K_{ sp}( AgY)=10^{-10}$,反应$ Ag_3 X+3 Y^-\rightleftharpoons3 AgY+ X^{3-}$,$K=\frac{c( X^{3-})}{c^3( Y^-)}=\frac{c( X^{3-})· c^3( Ag^+)}{c^3( Y^-)· c^3( Ag^+)}=\frac{K_{ sp}( Ag_3 X)}{K_{ sp}^3( AgY)}=10^{14}>10^5$,故向$ Ag_3 X$固体中加入$ NaY$溶液,可发生$ Ag_3 X\rightarrow AgY$的转化,C项正确。由图可知,$T$点体系中,$c( X^{3-})=c( Y^-)=c( Ag^+)=10^{-4}\ mol· L^{-1}$,此时$ Ag_3 X$处于沉淀溶解平衡状态,体系中$c( Ag^+)· c( Y^-)>K_{ sp}( AgY)$,生成$ AgY$沉淀,体系中$c( X^{3-})$不变,$c( Y^-)$、$c( Ag^+)$等量变小,故平衡时,$c( X^{3-})+c( Y^-)>2c( Ag^+)$,D项错误。
命题意图 本题考查难溶电解质的沉淀溶解平衡,掌握特殊点的意义是解题关键,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题思路 对于盐$ A_m B_n$,其溶度积$K_{ sp}( A_m B_n)=c^m( A^{n+})· c^n( B^{m-})$,$-\lg K_{ sp}( A_m B_n)=-m\lg c( A^{n+})-n\lg c( B^{m-})$。由图可知,曲线的斜率分别为$-x$和$-y$。$ Ag_3 X$曲线斜率为-3,即$x=3$,同理可知$y=1$,则$x:y=3:1$,A项正确。由图可知,若混合溶液中各离子浓度如J点所示,此时$\frac{c( X^{3-})}{c( Y^-)}=1$,加入$ AgNO_3( s)$,$c( Ag^+)$增大,$-\lg c( Ag^+)$减小,从图中看即向左移动,$c( X^{3-})$、$c( Y^-)$均减小,但$-\lg c( X^{3-})>-\lg c( Y^-)$,即$c( X^{3-})<c( Y^-)$,则$\frac{c( X^{3-})}{c( Y^-)}$变小,B项正确。由图可知,$K_{ sp}( Ag_3 X)=10^{-16}$,$K_{ sp}( AgY)=10^{-10}$,反应$ Ag_3 X+3 Y^-\rightleftharpoons3 AgY+ X^{3-}$,$K=\frac{c( X^{3-})}{c^3( Y^-)}=\frac{c( X^{3-})· c^3( Ag^+)}{c^3( Y^-)· c^3( Ag^+)}=\frac{K_{ sp}( Ag_3 X)}{K_{ sp}^3( AgY)}=10^{14}>10^5$,故向$ Ag_3 X$固体中加入$ NaY$溶液,可发生$ Ag_3 X\rightarrow AgY$的转化,C项正确。由图可知,$T$点体系中,$c( X^{3-})=c( Y^-)=c( Ag^+)=10^{-4}\ mol· L^{-1}$,此时$ Ag_3 X$处于沉淀溶解平衡状态,体系中$c( Ag^+)· c( Y^-)>K_{ sp}( AgY)$,生成$ AgY$沉淀,体系中$c( X^{3-})$不变,$c( Y^-)$、$c( Ag^+)$等量变小,故平衡时,$c( X^{3-})+c( Y^-)>2c( Ag^+)$,D项错误。
查看更多完整答案,请扫码查看


