2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. [2024·广西卷,15T,14分]广西盛产甘蔗,富藏锰矿。由软锰矿(MnO₂,含SiO₂、Fe₂O₃、Al₂O₃和CuO等杂质)制备光电材料KMnF₃的流程如下。
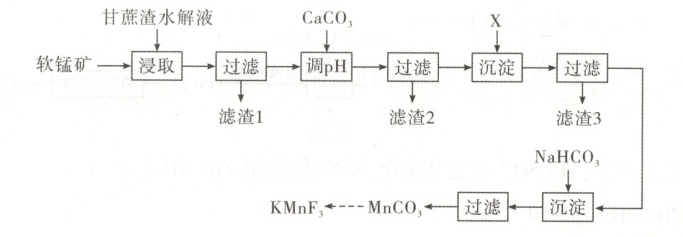
已知:
回答下列问题:
(1)“甘蔗渣水解液”中含有还原性糖和H₂SO₄,其主要作用是

(2)“滤渣1”的主要成分是
(3)常温下,用CaCO₃调节溶液pH至5~6时,可完全沉淀的离子有
(4)“X”可选用
A. H₂S
B. H₂O₂
C. Zn
D. (NH₄)₂S
(5)若用Na₂CO₃替代NaHCO₃沉锰,得到Mn₂(OH)₂CO₃沉淀。写出生成Mn₂(OH)₂CO₃的离子方程式
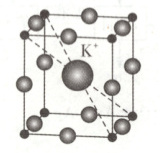
(6)KMnF₃立方晶胞如图,晶胞参数为a pm,该晶体中与一个F⁻紧邻的K⁺有

已知:
回答下列问题:
(1)“甘蔗渣水解液”中含有还原性糖和H₂SO₄,其主要作用是
溶解金属氧化物和还原软锰矿
。为提高“浸取”速率,可采取的措施是把软锰矿粉碎(或搅拌、加热等,任写一条)
(任举一例)。
(2)“滤渣1”的主要成分是
${SiO_{2}}$
(填化学式)。(3)常温下,用CaCO₃调节溶液pH至5~6时,可完全沉淀的离子有
${Al^{3+}}$
(填化学式)。(4)“X”可选用
D
。A. H₂S
B. H₂O₂
C. Zn
D. (NH₄)₂S
(5)若用Na₂CO₃替代NaHCO₃沉锰,得到Mn₂(OH)₂CO₃沉淀。写出生成Mn₂(OH)₂CO₃的离子方程式
${2Mn^{2+} + 3CO^{2-}_{3} + 2H_{2}O=Mn_{2}(OH)_{2}CO_{3}\downarrow + 2HCO^{-}_{3}}$
。(6)KMnF₃立方晶胞如图,晶胞参数为a pm,该晶体中与一个F⁻紧邻的K⁺有
4
个。已知Nₐ为阿伏加德罗常数的值,晶体密度为$\dfrac{151}{N_{A}a^{3}× 10^{-30}}$
g·cm⁻³(用含a、Nₐ的代数式表示)。
答案:
6. 参考答案
(1)溶解金属氧化物和还原软锰矿 把软锰矿粉碎(或搅拌、加热等,任写一条)
(2)${SiO_{2}}$
(3)${Al^{3+}}$
(4)${D}$
(5)${2Mn^{2+} + 3CO^{2-}_{3} + 2H_{2}O=Mn_{2}(OH)_{2}CO_{3}\downarrow + 2HCO^{-}_{3}}$
(6)$4$ $\dfrac{151}{N_{A}a^{3}× 10^{-30}}$
命题意图本题以软锰矿制备光电材料${KMnF_{3}}$的流程为情境,涉及元素化合物性质、分离提纯、晶胞的结构等知识,意在考查考生的分析推理能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路软锰矿含有${MnO_{2}}$和少量${SiO_{2}}$、${Fe_{2}O_{3}}$、${Al_{2}O_{3}}$、${CuO}$。“甘蔗渣水解液”中含有还原性糖和${H_{2}SO_{4}}$。用甘蔗渣水解液“浸取”软锰矿,${MnO_{2}\to MnSO_{4}}$,${Fe_{2}O_{3}\to FeSO_{4}}$,${Al_{2}O_{3}\to Al_{2}(SO_{4})_{3}}$,${CuO\to CuSO_{4}}$,${SiO_{2}}$不溶于硫酸,所得“滤渣1”是${SiO_{2}}$,滤液中加${CaCO_{3}}$调节${pH}$生成${Al(OH)_{3}}$沉淀除铝,“过滤”,滤液加硫化物反应生成${FeS}$、${CuS}$沉淀(“滤渣3”)除铁铜,滤液中加${NaHCO_{3}}$反应生成${MnCO_{3}}$沉淀,最终将${MnCO_{3}}$转化为${KMnF_{3}}$。
(3)根据溶度积常数,${Fe^{2+}}$完全沉淀时,$c{(OH^{-})}=\sqrt{\dfrac{4.9× 10^{-17}}{1× 10^{-5}}}\ {mol· L^{-1}}=7× 10^{-6}\ {mol· L^{-1}}$。${Al^{3+}}$完全沉淀时,$c{(OH^{-})}=\sqrt[3]{\dfrac{1.3× 10^{-33}}{1× 10^{-5}}}\ {mol· L^{-1}}\approx 5.1× 10^{-10}\ {mol· L^{-1}}$。${Cu^{2+}}$完全沉淀时,$c{(OH^{-})}=\sqrt{\dfrac{2.2× 10^{-20}}{1× 10^{-5}}}\ {mol· L^{-1}}\approx 4.7× 10^{-8}\ {mol· L^{-1}}$。常温下,用${CaCO_{3}}$调节溶液${pH}$至$5\sim 6$时,溶液中$c{(OH^{-})}$为$10^{-9}\sim 10^{-8}\ {mol· L^{-1}}$。则可完全沉淀的离子只有${Al^{3+}}$。
(4)加${X}$的目的是除铁和铜,${Fe^{2+}}$和${H_{2}S}$不反应,所以不能选用${H_{2}S}$。${Cu^{2+}}$、${Fe^{2+}}$都能分别和${S^{2-}}$反应生成${CuS}$、${FeS}$沉淀,所以“${X}$”可选用${(NH_{4})_{2}S}$,${D}$项符合题意。
(6)1个晶胞中含有1个${K^{+}}$,根据化学式${KMnF_{3}}$可知,1个晶胞中含有1个${Mn^{2+}}$、3个${F^{-}}$,则晶胞顶点上的$\boldsymbol{●}$为${Mn^{2+}}$、棱上的$\boldsymbol{●}$为${F^{-}}$,该晶体中与一个${F^{-}}$紧邻的${K^{+}}$有4个。已知$N_{A}$为阿伏加德罗常数的值,晶体密度为$\dfrac{39 + 55 + 19× 3}{(a× 10^{-10})^{3}× N_{A}}\ {g· cm^{-3}}=\dfrac{151}{N_{A}a^{3}× 10^{-30}}\ {g· cm^{-3}}$。
易错提醒
晶胞密度的计算是高考考查的高频考点,晶胞密度的计算需要特别注意两点:①计算晶胞质量时要先用“均摊法”确定一个晶胞中含有的原子总数目;②注意长度单位的换算,$1\ {cm}=10^{7}\ {nm}=10^{10}\ {pm}$。
(1)溶解金属氧化物和还原软锰矿 把软锰矿粉碎(或搅拌、加热等,任写一条)
(2)${SiO_{2}}$
(3)${Al^{3+}}$
(4)${D}$
(5)${2Mn^{2+} + 3CO^{2-}_{3} + 2H_{2}O=Mn_{2}(OH)_{2}CO_{3}\downarrow + 2HCO^{-}_{3}}$
(6)$4$ $\dfrac{151}{N_{A}a^{3}× 10^{-30}}$
命题意图本题以软锰矿制备光电材料${KMnF_{3}}$的流程为情境,涉及元素化合物性质、分离提纯、晶胞的结构等知识,意在考查考生的分析推理能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路软锰矿含有${MnO_{2}}$和少量${SiO_{2}}$、${Fe_{2}O_{3}}$、${Al_{2}O_{3}}$、${CuO}$。“甘蔗渣水解液”中含有还原性糖和${H_{2}SO_{4}}$。用甘蔗渣水解液“浸取”软锰矿,${MnO_{2}\to MnSO_{4}}$,${Fe_{2}O_{3}\to FeSO_{4}}$,${Al_{2}O_{3}\to Al_{2}(SO_{4})_{3}}$,${CuO\to CuSO_{4}}$,${SiO_{2}}$不溶于硫酸,所得“滤渣1”是${SiO_{2}}$,滤液中加${CaCO_{3}}$调节${pH}$生成${Al(OH)_{3}}$沉淀除铝,“过滤”,滤液加硫化物反应生成${FeS}$、${CuS}$沉淀(“滤渣3”)除铁铜,滤液中加${NaHCO_{3}}$反应生成${MnCO_{3}}$沉淀,最终将${MnCO_{3}}$转化为${KMnF_{3}}$。
(3)根据溶度积常数,${Fe^{2+}}$完全沉淀时,$c{(OH^{-})}=\sqrt{\dfrac{4.9× 10^{-17}}{1× 10^{-5}}}\ {mol· L^{-1}}=7× 10^{-6}\ {mol· L^{-1}}$。${Al^{3+}}$完全沉淀时,$c{(OH^{-})}=\sqrt[3]{\dfrac{1.3× 10^{-33}}{1× 10^{-5}}}\ {mol· L^{-1}}\approx 5.1× 10^{-10}\ {mol· L^{-1}}$。${Cu^{2+}}$完全沉淀时,$c{(OH^{-})}=\sqrt{\dfrac{2.2× 10^{-20}}{1× 10^{-5}}}\ {mol· L^{-1}}\approx 4.7× 10^{-8}\ {mol· L^{-1}}$。常温下,用${CaCO_{3}}$调节溶液${pH}$至$5\sim 6$时,溶液中$c{(OH^{-})}$为$10^{-9}\sim 10^{-8}\ {mol· L^{-1}}$。则可完全沉淀的离子只有${Al^{3+}}$。
(4)加${X}$的目的是除铁和铜,${Fe^{2+}}$和${H_{2}S}$不反应,所以不能选用${H_{2}S}$。${Cu^{2+}}$、${Fe^{2+}}$都能分别和${S^{2-}}$反应生成${CuS}$、${FeS}$沉淀,所以“${X}$”可选用${(NH_{4})_{2}S}$,${D}$项符合题意。
(6)1个晶胞中含有1个${K^{+}}$,根据化学式${KMnF_{3}}$可知,1个晶胞中含有1个${Mn^{2+}}$、3个${F^{-}}$,则晶胞顶点上的$\boldsymbol{●}$为${Mn^{2+}}$、棱上的$\boldsymbol{●}$为${F^{-}}$,该晶体中与一个${F^{-}}$紧邻的${K^{+}}$有4个。已知$N_{A}$为阿伏加德罗常数的值,晶体密度为$\dfrac{39 + 55 + 19× 3}{(a× 10^{-10})^{3}× N_{A}}\ {g· cm^{-3}}=\dfrac{151}{N_{A}a^{3}× 10^{-30}}\ {g· cm^{-3}}$。
易错提醒
晶胞密度的计算是高考考查的高频考点,晶胞密度的计算需要特别注意两点:①计算晶胞质量时要先用“均摊法”确定一个晶胞中含有的原子总数目;②注意长度单位的换算,$1\ {cm}=10^{7}\ {nm}=10^{10}\ {pm}$。
查看更多完整答案,请扫码查看


