2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. 用中子轰击$_{Z}^{N}X$原子产生α粒子(即氦核$_{2}^{4}He$)的核反应为$_{Z}^{N}X+_{0}^{1}n\longrightarrow$
A.H₃XO₃可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y₂O₂
C.X和氢元素形成离子化合物
D.$^{6}Y$和$^{7}Y$互为同素异形体
${}_{3}^{7}Li$
${P}^{7}Y+_{2}^{4}He$。已知元素Y在化合物中呈+1价。下列说法正确的是(A
)A.H₃XO₃可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y₂O₂
C.X和氢元素形成离子化合物
D.$^{6}Y$和$^{7}Y$互为同素异形体
答案:
5. 参考答案 A
命题意图 本题结合核反应考查元素化合物知识,考查考生对元素化合物知识的理解和掌握。
解题思路 Y在化合物中呈$+1$价,说明其处于第ⅠA族,而Y的质量数为7,则Y为${Li}$元素,即$P=3$;根据反应前后质子数和质量数守恒可知$Z=5$、$N=10$,即X为B元素。${H_{3}BO_{3}}$的酸性较弱,不具有腐蚀性,可用于中和溅在皮肤上的${NaOH}$溶液,A项正确。${Li}$在空气中燃烧只能生成${Li_{2}O}$,B项错误。B元素和H元素形成的${BH_{3}}$属于共价化合物,C项错误。${^{6}_{}Li}$和${^{7}_{}Li}$的质子数均为3,中子数分别为3和4,二者互为同位素,D项错误。
误区警示
同素异形体是同种元素组成的性质不同的单质,如金刚石和石墨、${O_{2}}$和${O_{3}}$等。同位素是质子数相同而中子数不同的同一元素的不同核素,如${^{12}_{6}C}$和${^{14}_{6}C}$。
命题意图 本题结合核反应考查元素化合物知识,考查考生对元素化合物知识的理解和掌握。
解题思路 Y在化合物中呈$+1$价,说明其处于第ⅠA族,而Y的质量数为7,则Y为${Li}$元素,即$P=3$;根据反应前后质子数和质量数守恒可知$Z=5$、$N=10$,即X为B元素。${H_{3}BO_{3}}$的酸性较弱,不具有腐蚀性,可用于中和溅在皮肤上的${NaOH}$溶液,A项正确。${Li}$在空气中燃烧只能生成${Li_{2}O}$,B项错误。B元素和H元素形成的${BH_{3}}$属于共价化合物,C项错误。${^{6}_{}Li}$和${^{7}_{}Li}$的质子数均为3,中子数分别为3和4,二者互为同位素,D项错误。
误区警示
同素异形体是同种元素组成的性质不同的单质,如金刚石和石墨、${O_{2}}$和${O_{3}}$等。同位素是质子数相同而中子数不同的同一元素的不同核素,如${^{12}_{6}C}$和${^{14}_{6}C}$。
6. BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:
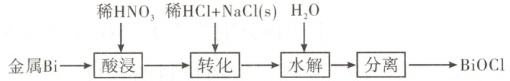
下列说法错误的是(
A.酸浸工序中分次加入稀HNO₃可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO₃
C.水解工序中加入少量CH₃COONa(s)可提高Bi³+水解程度
D.水解工序中加入少量NH₄NO₃(s)有利于BiOCl的生成

下列说法错误的是(
D
)A.酸浸工序中分次加入稀HNO₃可降低反应剧烈程度
B.转化工序中加入稀HCl可抑制生成BiONO₃
C.水解工序中加入少量CH₃COONa(s)可提高Bi³+水解程度
D.水解工序中加入少量NH₄NO₃(s)有利于BiOCl的生成
答案:
6. 参考答案 D
命题意图 本题结合工艺流程考查物质的制备和元素化合物间的转化,考查考生元素化合物知识的理解和掌握。
解题思路 ${Bi}$与${HNO_{3}}$反应放热会导致溶液的温度升高,反应速率加快,分多次加入稀${HNO_{3}}$可降低反应的剧烈程度,A项正确。${Bi^{3+}}$在溶液中易水解生成${BiO^{+}}$和${H^{+}}$,转化工序中加入稀盐酸能增大溶液中${H^{+}}$的浓度,抑制${BiONO_{3}}$的生成,B项正确。${Bi^{3+}}$水解,使溶液呈酸性,${CH_{3}COONa}$水解,使溶液呈碱性,二者混合能相互促进水解,即水解工序中加入少量${CH_{3}COONa}$能提高${Bi^{3+}}$的水解程度,C项正确。${NH_{4}NO_{3}}$水解使溶液呈酸性,${BiO^{+}}$水解使溶液也呈酸性,故加入少量${NH_{4}NO_{3}}$固体不利于${BiOCl}$的生成,同时$c({NO^{-}_{3}})$增大,可能含有${BiONO_{3}}$产生,使${BiOCl}$产率降低,D项错误。
技巧点拨
${Bi^{3+}}$水解的离子方程式为${Bi^{3+} + H_{2}O⇌ BiO^{+} + 2H^{+}}$,故向${Bi(NO_{3})_{3}}$溶液中加稀盐酸能抑制${Bi^{3+}}$水解。
命题意图 本题结合工艺流程考查物质的制备和元素化合物间的转化,考查考生元素化合物知识的理解和掌握。
解题思路 ${Bi}$与${HNO_{3}}$反应放热会导致溶液的温度升高,反应速率加快,分多次加入稀${HNO_{3}}$可降低反应的剧烈程度,A项正确。${Bi^{3+}}$在溶液中易水解生成${BiO^{+}}$和${H^{+}}$,转化工序中加入稀盐酸能增大溶液中${H^{+}}$的浓度,抑制${BiONO_{3}}$的生成,B项正确。${Bi^{3+}}$水解,使溶液呈酸性,${CH_{3}COONa}$水解,使溶液呈碱性,二者混合能相互促进水解,即水解工序中加入少量${CH_{3}COONa}$能提高${Bi^{3+}}$的水解程度,C项正确。${NH_{4}NO_{3}}$水解使溶液呈酸性,${BiO^{+}}$水解使溶液也呈酸性,故加入少量${NH_{4}NO_{3}}$固体不利于${BiOCl}$的生成,同时$c({NO^{-}_{3}})$增大,可能含有${BiONO_{3}}$产生,使${BiOCl}$产率降低,D项错误。
技巧点拨
${Bi^{3+}}$水解的离子方程式为${Bi^{3+} + H_{2}O⇌ BiO^{+} + 2H^{+}}$,故向${Bi(NO_{3})_{3}}$溶液中加稀盐酸能抑制${Bi^{3+}}$水解。
7. $N_{A}$是阿伏加德罗常数的值,下列说法错误的是(
A.22.4 L(标准状况)氟气所含的质子数为18$N_{A}$
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2$N_{A}$
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为$N_{A}$
D.1 L 1 mol·L⁻¹溴化铵水溶液中NH₄+与H+离子数之和大于$N_{A}$
C
)A.22.4 L(标准状况)氟气所含的质子数为18$N_{A}$
B.1 mol碘蒸气和1 mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2$N_{A}$
C.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数为$N_{A}$
D.1 L 1 mol·L⁻¹溴化铵水溶液中NH₄+与H+离子数之和大于$N_{A}$
答案:
7. 参考答案 C
命题意图 本题考查阿伏加德罗常数的应用,考查考生对基本概念、基本知识的理解和掌握。
解题思路 标准状况下,$22.4\ L$氟气(${F_{2}}$)的物质的量为$1\ mol$,所含质子数为$9× 2N_{ A}=18N_{ A}$,A项正确。氢气与碘蒸气生成碘化氢的反应为可逆反应,即使反应物的物质的量均为$1\ mol$时,生成碘化氢的分子数小于$2N_{ A}$,B项正确。电解饱和食盐水的总反应为${2NaCl + 2H_{2}O\xlongequal{ 电解}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow}$,阴阳两极产生$73\ g$气体时,即生成$1\ mol\ {H_{2}}$和$1\ mol\ {Cl_{2}}$,反应中转移电子数为$2N_{ A}$,C项错误。该溶液中含$1\ mol\ {NH_{4}Br}$,根据电荷守恒可知,$c({NH^{+}_{4}}) + c({H^{+}}) = c({Br^{-}}) + c({OH^{-}})$,体积一定时,则满足$n({NH^{+}_{4}}) + n({H^{+}}) = n({Br^{-}}) + n({OH^{-}})$,溶液中$n({Br^{-}}) = 1\ L× 1\ mol· L^{-1} = 1\ mol$,所以溶液中${NH^{+}_{4}}$和${H^{+}}$离子数之和大于$N_{ A}$,D项正确。
思路拓展
结合图像$0\sim 30\ min$内反应②生成$0.125\ mol· L^{-1}\ Z$可知,反应②消耗$0.125\ mol· L^{-1}\ M$,则反应①消耗$0.075\ mol· L^{-1}\ M$,即Y的浓度变化也为$0.075\ mol· L^{-1}$,Y的平均反应速率$v( Y) = \dfrac{0.075\ mol· L^{-1}}{30\ min} = 2.5× 10^{-3}\ mol· L^{-1}· min^{-1}$。
命题意图 本题考查阿伏加德罗常数的应用,考查考生对基本概念、基本知识的理解和掌握。
解题思路 标准状况下,$22.4\ L$氟气(${F_{2}}$)的物质的量为$1\ mol$,所含质子数为$9× 2N_{ A}=18N_{ A}$,A项正确。氢气与碘蒸气生成碘化氢的反应为可逆反应,即使反应物的物质的量均为$1\ mol$时,生成碘化氢的分子数小于$2N_{ A}$,B项正确。电解饱和食盐水的总反应为${2NaCl + 2H_{2}O\xlongequal{ 电解}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow}$,阴阳两极产生$73\ g$气体时,即生成$1\ mol\ {H_{2}}$和$1\ mol\ {Cl_{2}}$,反应中转移电子数为$2N_{ A}$,C项错误。该溶液中含$1\ mol\ {NH_{4}Br}$,根据电荷守恒可知,$c({NH^{+}_{4}}) + c({H^{+}}) = c({Br^{-}}) + c({OH^{-}})$,体积一定时,则满足$n({NH^{+}_{4}}) + n({H^{+}}) = n({Br^{-}}) + n({OH^{-}})$,溶液中$n({Br^{-}}) = 1\ L× 1\ mol· L^{-1} = 1\ mol$,所以溶液中${NH^{+}_{4}}$和${H^{+}}$离子数之和大于$N_{ A}$,D项正确。
思路拓展
结合图像$0\sim 30\ min$内反应②生成$0.125\ mol· L^{-1}\ Z$可知,反应②消耗$0.125\ mol· L^{-1}\ M$,则反应①消耗$0.075\ mol· L^{-1}\ M$,即Y的浓度变化也为$0.075\ mol· L^{-1}$,Y的平均反应速率$v( Y) = \dfrac{0.075\ mol· L^{-1}}{30\ min} = 2.5× 10^{-3}\ mol· L^{-1}· min^{-1}$。
8. 苯并降冰片烯是一种重要的药物合成中间体,结构简式如图。关于该化合物,下列说法正确的是(
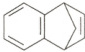
A.是苯的同系物
B.分子中最多8个碳原子共平面
C.一氯代物有6种(不考虑立体异构)
D.分子中含有4个碳碳双键
B
)
A.是苯的同系物
B.分子中最多8个碳原子共平面
C.一氯代物有6种(不考虑立体异构)
D.分子中含有4个碳碳双键
答案:
8. 参考答案 B
命题意图 本题考查有机物的结构与性质,考查考生有机化合物结构与性质的理解和掌握。
解题思路 苯的同系物是苯环上氢原子被烷基取代的产物,该物质不属于苯的同系物,A项错误。该分子中与苯环直接相连的$2$个碳原子一定在苯环所在的平面上,右侧环上含有饱和碳原子,即最多有$8$个碳原子共平面,B项正确。该分子上下对称,分子中含有$5$种不同化学环境的氢原子,其一氯代物共有$5$种,C项错误。苯环中的碳碳键是介于碳碳单键和碳碳双键之间独特的化学键,即苯环中不含碳碳双键,该分子中仅含$1$个碳碳双键,D项错误。
命题意图 本题考查有机物的结构与性质,考查考生有机化合物结构与性质的理解和掌握。
解题思路 苯的同系物是苯环上氢原子被烷基取代的产物,该物质不属于苯的同系物,A项错误。该分子中与苯环直接相连的$2$个碳原子一定在苯环所在的平面上,右侧环上含有饱和碳原子,即最多有$8$个碳原子共平面,B项正确。该分子上下对称,分子中含有$5$种不同化学环境的氢原子,其一氯代物共有$5$种,C项错误。苯环中的碳碳键是介于碳碳单键和碳碳双键之间独特的化学键,即苯环中不含碳碳双键,该分子中仅含$1$个碳碳双键,D项错误。
9. K-O₂电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是(
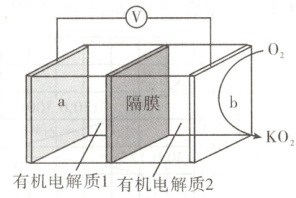
A.隔膜允许K+通过,不允许O₂通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO₂的质量与消耗O₂的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
D
)
A.隔膜允许K+通过,不允许O₂通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1 Ah电量时,生成KO₂的质量与消耗O₂的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9 g钾时,铅酸蓄电池消耗0.9 g水
答案:
9. 参考答案 D
命题意图 本题考查化学电源,考查考生电化学知识的理解和掌握。
解题思路 结合图示可知,在b电极表面${O_{2}}$转化为${KO_{2}}$,发生还原反应,b电极为正极,则a电极为负极,放电时${K^{+}}$由负极通过隔膜向正极移动,隔膜不允许${O_{2}}$通过,否则${K^{+}}$会直接与${O_{2}}$反应生成${KO_{2}}$,不能将化学能转化为电能,A项正确。放电时电流由正极经外电路流回负极,即电流由b电极经导线流向a电极,充电时原电池的正极作电解池的阳极,B项正确。该电池中每生成$1\ mol\ {KO_{2}}$时消耗$1\ mol\ {O_{2}}$,$1\ mol\ {KO_{2}}$、${O_{2}}$的质量分别为$71\ g$和$32\ g$,即二者的质量比为$\dfrac{71\ g}{32\ g} \approx 2.22$,与产生的电量无关,C项正确。铅蓄电池充电时总反应为${2PbSO_{4} + 2H_{2}O\xlongequal{}Pb + PbO_{2} + 2H_{2}SO_{4}}$,该电池为铅蓄电池充电时,若消耗$3.9\ g\ {K}$,则电路中转移$0.1\ mol$电子,根据铅蓄电池总反应可知$2\ mol\ {H_{2}O}\sim 2\ mol$电子,即转移$0.1\ mol$电子时消耗$0.1\ mol\ {H_{2}O}$,其质量为$1.8\ g$,D项错误。
技巧点拨
根据图示右侧${O_{2}\to KO_{2}}$,可判断b电极为正极,结合题中信息—电极为钾片可知,a电极为钾片;充电时原负极a发生还原反应为阴极,原正极b发生氧化反应为阳极。C项计算二者质量比时与电量无关,即二者的质量比为定值,不要受$1\ Ah$的干扰。
命题意图 本题考查化学电源,考查考生电化学知识的理解和掌握。
解题思路 结合图示可知,在b电极表面${O_{2}}$转化为${KO_{2}}$,发生还原反应,b电极为正极,则a电极为负极,放电时${K^{+}}$由负极通过隔膜向正极移动,隔膜不允许${O_{2}}$通过,否则${K^{+}}$会直接与${O_{2}}$反应生成${KO_{2}}$,不能将化学能转化为电能,A项正确。放电时电流由正极经外电路流回负极,即电流由b电极经导线流向a电极,充电时原电池的正极作电解池的阳极,B项正确。该电池中每生成$1\ mol\ {KO_{2}}$时消耗$1\ mol\ {O_{2}}$,$1\ mol\ {KO_{2}}$、${O_{2}}$的质量分别为$71\ g$和$32\ g$,即二者的质量比为$\dfrac{71\ g}{32\ g} \approx 2.22$,与产生的电量无关,C项正确。铅蓄电池充电时总反应为${2PbSO_{4} + 2H_{2}O\xlongequal{}Pb + PbO_{2} + 2H_{2}SO_{4}}$,该电池为铅蓄电池充电时,若消耗$3.9\ g\ {K}$,则电路中转移$0.1\ mol$电子,根据铅蓄电池总反应可知$2\ mol\ {H_{2}O}\sim 2\ mol$电子,即转移$0.1\ mol$电子时消耗$0.1\ mol\ {H_{2}O}$,其质量为$1.8\ g$,D项错误。
技巧点拨
根据图示右侧${O_{2}\to KO_{2}}$,可判断b电极为正极,结合题中信息—电极为钾片可知,a电极为钾片;充电时原负极a发生还原反应为阴极,原正极b发生氧化反应为阳极。C项计算二者质量比时与电量无关,即二者的质量比为定值,不要受$1\ Ah$的干扰。
查看更多完整答案,请扫码查看


