2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. [2025·江苏卷,5T,3 分]下列说法正确的是(
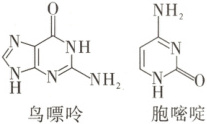
A.硫黄有 S₂、S²⁻、S₄ 等多种同素异形体
B.高温下青蒿素分子结构稳定
C.NH₃ 分子中 H—N—H 键角大于 CH₄ 分子中 H—C—H 键角
D.题图所示的碱基鸟嘌呤与胞嘧啶通过氢键互补配对
D
)
A.硫黄有 S₂、S²⁻、S₄ 等多种同素异形体
B.高温下青蒿素分子结构稳定
C.NH₃ 分子中 H—N—H 键角大于 CH₄ 分子中 H—C—H 键角
D.题图所示的碱基鸟嘌呤与胞嘧啶通过氢键互补配对
答案:
6.参考答案D
命题意图本题综合考查硫的同素异形体、键角比较、碱基互补配对等知识,体现了“证据推理与模型认知”“科学态度与社会责任”等化学学科核心素养。
解题思路同种元素形成的不同单质互为同素异形体,${S^{2-}}$是离子不是单质,A项错误。根据信息可知,青蒿素中含有—O—O—(类比H₂O₂),不稳定,高温条件下易分解,故高温下青蒿素分子结构不稳定,B项错误。${NH_{3}}$中心原子N原子的价层电子对数为$3 + \frac{1}{2} × (5 - 1 × 3) = 4$,采用${sp^{3}}$杂化,孤电子对数为1,${CH_{4}}$中心原子C原子的价层电子对数为$4 + \frac{1}{2} × (4 - 1 × 4) = 4$,采用${sp^{3}}$杂化,孤电子对数为0,中心原子杂化方式相同时,孤电子对数越多,孤电子对对成键电子对的排斥力越大,键角越小,则${NH_{3}}$分子中H—N—H键角小于${CH_{4}}$分子中H—C—H键角,C项错误。鸟嘌呤、胞嘧啶中含有—NH—、—NH₂、O原子、N原子,可通过氢键实现互补配对,如图所示 ,D项正确。
,D项正确。
6.参考答案D
命题意图本题综合考查硫的同素异形体、键角比较、碱基互补配对等知识,体现了“证据推理与模型认知”“科学态度与社会责任”等化学学科核心素养。
解题思路同种元素形成的不同单质互为同素异形体,${S^{2-}}$是离子不是单质,A项错误。根据信息可知,青蒿素中含有—O—O—(类比H₂O₂),不稳定,高温条件下易分解,故高温下青蒿素分子结构不稳定,B项错误。${NH_{3}}$中心原子N原子的价层电子对数为$3 + \frac{1}{2} × (5 - 1 × 3) = 4$,采用${sp^{3}}$杂化,孤电子对数为1,${CH_{4}}$中心原子C原子的价层电子对数为$4 + \frac{1}{2} × (4 - 1 × 4) = 4$,采用${sp^{3}}$杂化,孤电子对数为0,中心原子杂化方式相同时,孤电子对数越多,孤电子对对成键电子对的排斥力越大,键角越小,则${NH_{3}}$分子中H—N—H键角小于${CH_{4}}$分子中H—C—H键角,C项错误。鸟嘌呤、胞嘧啶中含有—NH—、—NH₂、O原子、N原子,可通过氢键实现互补配对,如图所示
 ,D项正确。
,D项正确。 7. [2025·山东卷,8T,2 分]物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是(

A
)
答案:
7.参考答案A
命题意图本题考查物质结构与性质,涉及电离能、电负性、晶体性质等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路H₂O沸点高于H₂S的主要原因是H₂O分子间存在氢键,H₂S分子间不存在氢键,与电离能无关,A项错误。HClO酸性强于HBrO是因为Cl的电负性大于Br,导致O—H键极性更强,更易解离出${H^{+}}$,B项正确。金刚石硬度大于晶体硅是因为二者均为共价晶体,C原子半径小于Si,C—C键键长更短、键能更大,C项正确。MgO和NaF均属于离子晶体,离子半径越小、离子所带电荷越多,对应离子晶体的熔点越高。所带电荷${Mg^{2+} > Na^{+}}$,${O^{2-} > F^{-}}$,故MgO中离子键更强,晶体熔点更高,D项正确。
命题意图本题考查物质结构与性质,涉及电离能、电负性、晶体性质等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路H₂O沸点高于H₂S的主要原因是H₂O分子间存在氢键,H₂S分子间不存在氢键,与电离能无关,A项错误。HClO酸性强于HBrO是因为Cl的电负性大于Br,导致O—H键极性更强,更易解离出${H^{+}}$,B项正确。金刚石硬度大于晶体硅是因为二者均为共价晶体,C原子半径小于Si,C—C键键长更短、键能更大,C项正确。MgO和NaF均属于离子晶体,离子半径越小、离子所带电荷越多,对应离子晶体的熔点越高。所带电荷${Mg^{2+} > Na^{+}}$,${O^{2-} > F^{-}}$,故MgO中离子键更强,晶体熔点更高,D项正确。
8. [2025·甘肃卷,9T,3 分]我国化学家合成了一种带有空腔的杯状主体分子(结构式如图甲),该分子和客体分子(CH₃)₄NCl 可形成主客体包合物:(CH₃)₄N⁺被固定在空腔内部(结构示意图见图乙)。下列说法错误的是(
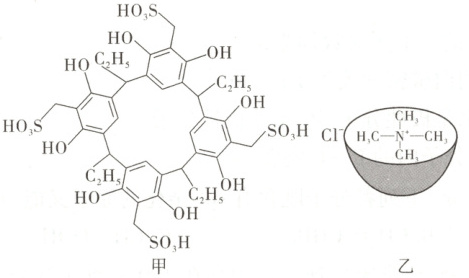
A.主体分子存在分子内氢键
B.主客体分子之间存在共价键
C.磺酸基中的 S—O 键能比 S = O 小
D.(CH₃)₄N⁺和(CH₃)₃N 中 N 均采用 sp³ 杂化
B
)
A.主体分子存在分子内氢键
B.主客体分子之间存在共价键
C.磺酸基中的 S—O 键能比 S = O 小
D.(CH₃)₄N⁺和(CH₃)₃N 中 N 均采用 sp³ 杂化
答案:
8.参考答案B
命题意图本题以一种带有空腔的杯状主体分子为情境,考查分子内氢键、超分子、键能、杂化方式等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路主体分子内含有羟基和磺酸基(${-SO_{3}H}$),可以形成分子内氢键,A项正确。主体与客体间通过分子间相互作用形成超分子,而非共价键,B项错误。单键只含有σ键,双键含有σ键和π键,则磺酸基中S—O键能比S═O小,C项正确。${(CH_{3})_{4}N^{+}}$的中心N原子的价层电子对数为4,无孤电子对,采用${sp^{3}}$杂化,${(CH_{3})_{3}N}$的中心N原子形成3条σ键,价层电子对数为4,有1个孤电子对,采用${sp^{3}}$杂化,D项正确。
命题意图本题以一种带有空腔的杯状主体分子为情境,考查分子内氢键、超分子、键能、杂化方式等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路主体分子内含有羟基和磺酸基(${-SO_{3}H}$),可以形成分子内氢键,A项正确。主体与客体间通过分子间相互作用形成超分子,而非共价键,B项错误。单键只含有σ键,双键含有σ键和π键,则磺酸基中S—O键能比S═O小,C项正确。${(CH_{3})_{4}N^{+}}$的中心N原子的价层电子对数为4,无孤电子对,采用${sp^{3}}$杂化,${(CH_{3})_{3}N}$的中心N原子形成3条σ键,价层电子对数为4,有1个孤电子对,采用${sp^{3}}$杂化,D项正确。
9. [2025·甘肃卷,10T,3 分]我国科学家制备了具有优良双折射性能的 C₃H₈N₆I₆·3H₂O 材料。下列说法正确的是(
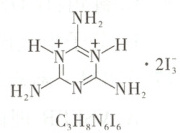
A.电负性 N < C < O
B.原子半径 C < N < O
C.I₃⁻ 中所有 I 的孤电子对数相同
D.C₃H₈N₆²⁺ 中所有 N—H 极性相同
C
)
A.电负性 N < C < O
B.原子半径 C < N < O
C.I₃⁻ 中所有 I 的孤电子对数相同
D.C₃H₈N₆²⁺ 中所有 N—H 极性相同
答案:
9.参考答案C
命题意图本题考查物质的结构与性质,涉及元素周期律、孤电子对数、极性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路同一周期的主族元素从左到右,电负性逐渐增大,故电负性${C < N < O}$,A项错误。同周期的主族元素从左到右,原子半径逐渐减小,故原子半径${C > N > O}$,B项错误。${I^{-}_{3}}$中心I原子与两个I原子通过共用电子对形成共价键,则两边的I原子各提供1个电子形成σ键,剩余6个电子构成3个孤电子对,中心原子I的孤电子对数是$\frac{7 + 1 - 2 × 1}{2} = 3$,C项正确。${N^{+}}$带正电,吸电子能力更强,${N^{+} - H}$键极性更大,则${C_{3}H_{8}N^{2+}_{6}}$中N—H极性不完全相同,D项错误。
学习拓展
碘三负离子(${I^{-}_{3}}$)的结构
碘三负离子(${I^{-}_{3}}$)由三个碘原子组成,带有一个单位的负电荷。其中心碘原子采取${sp^{3}d}$杂化方式,周围的两个碘原子分别占据轴向位置。这种结构使得${I^{-}_{3}}$呈现出直线形,三个碘原子在同一条直线上。中心碘原子周围有5个价层电子对,其中2个成键电子对,3个孤电子对。
命题意图本题考查物质的结构与性质,涉及元素周期律、孤电子对数、极性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路同一周期的主族元素从左到右,电负性逐渐增大,故电负性${C < N < O}$,A项错误。同周期的主族元素从左到右,原子半径逐渐减小,故原子半径${C > N > O}$,B项错误。${I^{-}_{3}}$中心I原子与两个I原子通过共用电子对形成共价键,则两边的I原子各提供1个电子形成σ键,剩余6个电子构成3个孤电子对,中心原子I的孤电子对数是$\frac{7 + 1 - 2 × 1}{2} = 3$,C项正确。${N^{+}}$带正电,吸电子能力更强,${N^{+} - H}$键极性更大,则${C_{3}H_{8}N^{2+}_{6}}$中N—H极性不完全相同,D项错误。
学习拓展
碘三负离子(${I^{-}_{3}}$)的结构
碘三负离子(${I^{-}_{3}}$)由三个碘原子组成,带有一个单位的负电荷。其中心碘原子采取${sp^{3}d}$杂化方式,周围的两个碘原子分别占据轴向位置。这种结构使得${I^{-}_{3}}$呈现出直线形,三个碘原子在同一条直线上。中心碘原子周围有5个价层电子对,其中2个成键电子对,3个孤电子对。
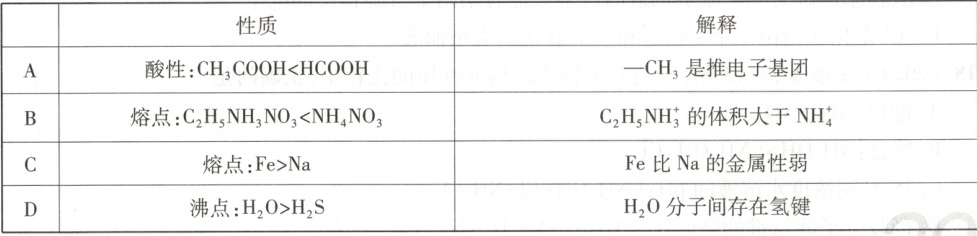
10. [2025·湖南卷,5T,3 分]下列有关物质性质的解释错误的是(
C
)
答案:
10.参考答案C
命题意图本题考查物质性质与结构的关系,体现了“宏观辨识与微观探析”“变化观念与平衡思想”等化学学科核心素养。
解题思路 —${CH_{3}}$是推电子基团,使${CH_{3}COOH}$中羟基的极性减弱,因而${CH_{3}COOH}$的酸性弱于${HCOOH}$,A项正确。${C_{2}H_{5}NH^{+}_{3}}$的体积大于${NH^{+}_{4}}$,${C_{2}H_{5}NH_{3}NO_{3}}$形成离子液体,熔点更低,B项正确。Fe熔点高于Na是因Fe中金属键更强,与金属性无关,金属性是金属原子失电子的能力,与金属熔点无关,C项错误。${H_{2}O}$分子间氢键使其沸点高于${H_{2}S}$,D项正确。
追根溯源
${C_{2}H_{5}NH_{3}NO_{3}}$是离子液体,熔点只有12℃,比${NH_{4}NO_{3}}$低了158℃,这个已知来自人教版选择性必修2有关于离子液体的介绍中。离子液体是在室温或稍高于室温时呈液态的离子化合物,大多数含有体积较大的阴、阳离子。离子液体具有难挥发的优点,这是由于离子液体的粒子全部是带电荷的离子。离子液体可用作溶剂,具有良好的导电性,被用于有机合成的溶剂和催化剂。
命题意图本题考查物质性质与结构的关系,体现了“宏观辨识与微观探析”“变化观念与平衡思想”等化学学科核心素养。
解题思路 —${CH_{3}}$是推电子基团,使${CH_{3}COOH}$中羟基的极性减弱,因而${CH_{3}COOH}$的酸性弱于${HCOOH}$,A项正确。${C_{2}H_{5}NH^{+}_{3}}$的体积大于${NH^{+}_{4}}$,${C_{2}H_{5}NH_{3}NO_{3}}$形成离子液体,熔点更低,B项正确。Fe熔点高于Na是因Fe中金属键更强,与金属性无关,金属性是金属原子失电子的能力,与金属熔点无关,C项错误。${H_{2}O}$分子间氢键使其沸点高于${H_{2}S}$,D项正确。
追根溯源
${C_{2}H_{5}NH_{3}NO_{3}}$是离子液体,熔点只有12℃,比${NH_{4}NO_{3}}$低了158℃,这个已知来自人教版选择性必修2有关于离子液体的介绍中。离子液体是在室温或稍高于室温时呈液态的离子化合物,大多数含有体积较大的阴、阳离子。离子液体具有难挥发的优点,这是由于离子液体的粒子全部是带电荷的离子。离子液体可用作溶剂,具有良好的导电性,被用于有机合成的溶剂和催化剂。
查看更多完整答案,请扫码查看


