2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
13. [2024·广西卷,9T,3 分]某新型钠离子二次电池(如图)用溶解了 NaPF₆的二甲氧基乙烷作电解质溶液。放电时嵌入 PbSe 中的 Na 变成 Na⁺后脱嵌。下列说法错误的是(
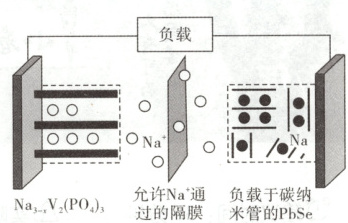
A.外电路通过 1 mol 电子时,理论上两电极质量变化的差值为 23 g
B.充电时,阳极电极反应为:Na₃V₂(PO₄)₃ - xe⁻ = Na₃ - xV₂(PO₄)₃ + xNa⁺
C.放电一段时间后,电解质溶液中的 Na⁺浓度基本保持不变
D.电解质溶液不能用 NaPF₆的水溶液替换
A
)
A.外电路通过 1 mol 电子时,理论上两电极质量变化的差值为 23 g
B.充电时,阳极电极反应为:Na₃V₂(PO₄)₃ - xe⁻ = Na₃ - xV₂(PO₄)₃ + xNa⁺
C.放电一段时间后,电解质溶液中的 Na⁺浓度基本保持不变
D.电解质溶液不能用 NaPF₆的水溶液替换
答案:
13. 参考答案 A
命题意图 本题以新型钠离子二次电池为载体,考查电极反应、电化学计算、电解质中离子浓度变化等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 放电时嵌入${PbSe}$中的${Na}$变成${Na^{+}}$后脱嵌,则右侧电极为负极,则左侧电极为正极。外电路通过$1\ mol$电子时,负极有$1\ mol\ {Na}$失电子生成${Na^{+}}$进入右侧溶液,溶液中有$1\ mol\ {Na^{+}}$通过隔膜从右侧进入左侧,并与正极的${Na_{3 - x}V_{2}(PO_{4})_{3}}$结合,则理论上两电极质量变化的差值为$2\ mol × 23\ g·mol^{-1} = 46\ g$,A项错误。充电时,左侧电极为阳极,${Na_{3}V_{2}(PO_{4})_{3}}$失电子生成${Na_{3 - x}V_{2}(PO_{4})_{3}}$,B项正确。放电时,电池的总反应为${xNa + Na_{3 - x}V_{2}(PO_{4})_{3} = Na_{3}V_{2}(PO_{4})_{3}}$,故电解质溶液中的${Na^{+}}$浓度基本保持不变,C项正确。${Na}$能与水反应,所以电解质溶液不能用${NaPF_{6}}$的水溶液替换,D项正确。
电池分析
放电:${Na_{3 - x}V_{2}(PO_{4})_{3} + xe^{-} + xNa^{+} = Na_{3}V_{2}(PO_{4})_{3}}$;${Na - e^{-} = Na^{+}}$
充电:${Na_{3}V_{2}(PO_{4})_{3} - xe^{-} = Na_{3 - x}V_{2}(PO_{4})_{3} + xNa^{+}}$;${Na^{+} + e^{-} = Na}$

13. 参考答案 A
命题意图 本题以新型钠离子二次电池为载体,考查电极反应、电化学计算、电解质中离子浓度变化等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 放电时嵌入${PbSe}$中的${Na}$变成${Na^{+}}$后脱嵌,则右侧电极为负极,则左侧电极为正极。外电路通过$1\ mol$电子时,负极有$1\ mol\ {Na}$失电子生成${Na^{+}}$进入右侧溶液,溶液中有$1\ mol\ {Na^{+}}$通过隔膜从右侧进入左侧,并与正极的${Na_{3 - x}V_{2}(PO_{4})_{3}}$结合,则理论上两电极质量变化的差值为$2\ mol × 23\ g·mol^{-1} = 46\ g$,A项错误。充电时,左侧电极为阳极,${Na_{3}V_{2}(PO_{4})_{3}}$失电子生成${Na_{3 - x}V_{2}(PO_{4})_{3}}$,B项正确。放电时,电池的总反应为${xNa + Na_{3 - x}V_{2}(PO_{4})_{3} = Na_{3}V_{2}(PO_{4})_{3}}$,故电解质溶液中的${Na^{+}}$浓度基本保持不变,C项正确。${Na}$能与水反应,所以电解质溶液不能用${NaPF_{6}}$的水溶液替换,D项正确。
电池分析
放电:${Na_{3 - x}V_{2}(PO_{4})_{3} + xe^{-} + xNa^{+} = Na_{3}V_{2}(PO_{4})_{3}}$;${Na - e^{-} = Na^{+}}$
充电:${Na_{3}V_{2}(PO_{4})_{3} - xe^{-} = Na_{3 - x}V_{2}(PO_{4})_{3} + xNa^{+}}$;${Na^{+} + e^{-} = Na}$

14. [2024·湖北卷,14T,3 分]我国科学家设计了一种双位点 PbCu 电催化剂,用 H₂C₂O₄和 NH₂OH 电化学催化合成甘氨酸,原理如图,双极膜中 H₂O 解离的 H⁺和 OH⁻在电场作用下向两极迁移。已知在 KOH 溶液中,甲醛转化为 HOCH₂⁻,存在平衡 HOCH₂⁻ + OH⁻ $\xlongequal{}$ [OCH₂O]²⁻ + H₂O。Cu 电极上发生的电子转移反应为[OCH₂O]²⁻ - e⁻ $\xlongequal{}$ HCOO⁻ + H·。下列说法错误的是(
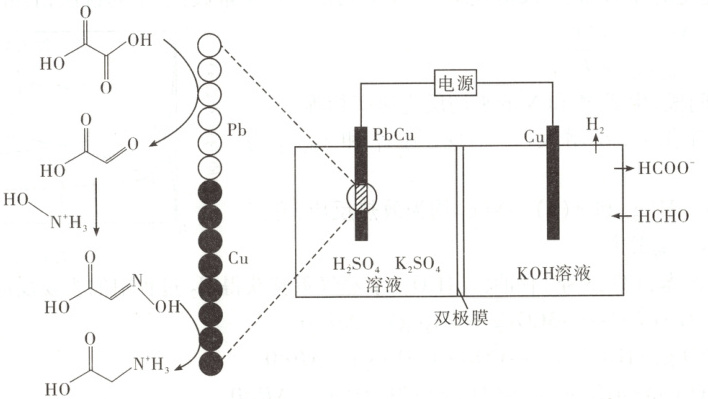
A.电解一段时间后阳极区 c(OH⁻)减小
B.理论上生成 1 mol H₃N⁺CH₂COOH 双极膜中有 4 mol H₂O 解离
C.阳极总反应式为 2HCHO + 4OH⁻ - 2e⁻ = 2HCOO⁻ + H₂↑ + 2H₂O
D.阴极区存在反应 H₂C₂O₄ + 2H⁺ + 2e⁻ = CHOCCOOH + H₂O
B
)
A.电解一段时间后阳极区 c(OH⁻)减小
B.理论上生成 1 mol H₃N⁺CH₂COOH 双极膜中有 4 mol H₂O 解离
C.阳极总反应式为 2HCHO + 4OH⁻ - 2e⁻ = 2HCOO⁻ + H₂↑ + 2H₂O
D.阴极区存在反应 H₂C₂O₄ + 2H⁺ + 2e⁻ = CHOCCOOH + H₂O
答案:
14. 参考答案 B
命题意图 本题以电催化合成甘氨酸为素材,意在考查考生的识图能力以及理解分析能力,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 在${KOH}$溶液中${HCHO}$转化为${HOCH_{2}O^{-}}$,存在平衡${HOCH_{2}O^{-} + OH^{-} ⇌ [OCH_{2}O]^{2-} + H_{2}O}$,${Cu}$电极上发生的电子转移反应为${[OCH_{2}O]^{2-} - e^{-} = HCOO^{-} + H·}$,${H·}$结合成${H_{2}}$,${Cu}$电极为阳极;${PbCu}$电极为阴极,首先${HOOC - COOH}$在${Pb}$上发生得电子的还原反应转化为${OHC - COOH}$,反应为${H_{2}C_{2}O_{4} + 2e^{-} + 2H^{+} = OHC - COOH + H_{2}O}$,${OHC - COOH}$与${HO - N^{+}H_{3}}$反应生成${HOOC - CH = N - OH}$,反应为${OHC - COOH + HO - N^{+}H_{3} \longrightarrow HOOC - CH = N - OH + H_{2}O + H^{+}}$,${HOOC - CH = N - OH}$发生得电子的还原反应转化成${H_{3}N^{+}CH_{2}COOH}$,反应为${HOOC - CH = N - OH + 4e^{-} + 5H^{+} = H_{3}N^{+}CH_{2}COOH + H_{2}O}$。双极膜中解离的${H^{+}}$向阴极(${PbCu}$电极)移动,${OH^{-}}$向阳极(${Cu}$电极)移动。电解过程中,阳极总反应式为${2HCHO + 4OH^{-} - 2e^{-} = 2HCOO^{-} + H_{2}\uparrow + 2H_{2}O}$,根据电荷守恒和转移电子守恒,阳极区每消耗$4\ mol\ {OH^{-}}$,双极膜解离出$2\ mol\ {OH^{-}}$移向阳极,故电解一段时间后阳极区$c{(OH^{-})}$减小,A、C项均正确。阴极区的总反应为${H_{2}C_{2}O_{4} + HO - N^{+}H_{3} + 6e^{-} + 6H^{+} = H_{3}N^{+}CH_{2}COOH + 3H_{2}O}$,理论上生成$1\ mol\ {H_{3}N^{+}CH_{2}COOH}$转移$6\ mol\ {e^{-}}$,则双极膜中有$6\ mol\ {H^{+}}$移向阴极,即双极膜中有$6\ mol\ {H_{2}O}$解离,B项错误。阴极区的${Pb}$上发生反应${H_{2}C_{2}O_{4} + 2e^{-} + 2H^{+} = CHOCOOH + H_{2}O}$,D项正确。
命题意图 本题以电催化合成甘氨酸为素材,意在考查考生的识图能力以及理解分析能力,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 在${KOH}$溶液中${HCHO}$转化为${HOCH_{2}O^{-}}$,存在平衡${HOCH_{2}O^{-} + OH^{-} ⇌ [OCH_{2}O]^{2-} + H_{2}O}$,${Cu}$电极上发生的电子转移反应为${[OCH_{2}O]^{2-} - e^{-} = HCOO^{-} + H·}$,${H·}$结合成${H_{2}}$,${Cu}$电极为阳极;${PbCu}$电极为阴极,首先${HOOC - COOH}$在${Pb}$上发生得电子的还原反应转化为${OHC - COOH}$,反应为${H_{2}C_{2}O_{4} + 2e^{-} + 2H^{+} = OHC - COOH + H_{2}O}$,${OHC - COOH}$与${HO - N^{+}H_{3}}$反应生成${HOOC - CH = N - OH}$,反应为${OHC - COOH + HO - N^{+}H_{3} \longrightarrow HOOC - CH = N - OH + H_{2}O + H^{+}}$,${HOOC - CH = N - OH}$发生得电子的还原反应转化成${H_{3}N^{+}CH_{2}COOH}$,反应为${HOOC - CH = N - OH + 4e^{-} + 5H^{+} = H_{3}N^{+}CH_{2}COOH + H_{2}O}$。双极膜中解离的${H^{+}}$向阴极(${PbCu}$电极)移动,${OH^{-}}$向阳极(${Cu}$电极)移动。电解过程中,阳极总反应式为${2HCHO + 4OH^{-} - 2e^{-} = 2HCOO^{-} + H_{2}\uparrow + 2H_{2}O}$,根据电荷守恒和转移电子守恒,阳极区每消耗$4\ mol\ {OH^{-}}$,双极膜解离出$2\ mol\ {OH^{-}}$移向阳极,故电解一段时间后阳极区$c{(OH^{-})}$减小,A、C项均正确。阴极区的总反应为${H_{2}C_{2}O_{4} + HO - N^{+}H_{3} + 6e^{-} + 6H^{+} = H_{3}N^{+}CH_{2}COOH + 3H_{2}O}$,理论上生成$1\ mol\ {H_{3}N^{+}CH_{2}COOH}$转移$6\ mol\ {e^{-}}$,则双极膜中有$6\ mol\ {H^{+}}$移向阴极,即双极膜中有$6\ mol\ {H_{2}O}$解离,B项错误。阴极区的${Pb}$上发生反应${H_{2}C_{2}O_{4} + 2e^{-} + 2H^{+} = CHOCOOH + H_{2}O}$,D项正确。
15. [2024·浙江 6 月卷,13T,3 分]金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。如图为两种对海水中钢闸门的防腐措施示意图:
下列说法正确的是(
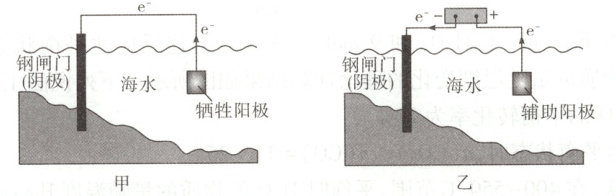
A.图甲、图乙中,阳极材料本身均失去电子
B.图乙中,外加电压偏高时,钢闸门表面可发生反应 O₂ + 4e⁻ + 2H₂O = 4OH⁻
C.图乙中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图甲、图乙中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
下列说法正确的是(
B
)
A.图甲、图乙中,阳极材料本身均失去电子
B.图乙中,外加电压偏高时,钢闸门表面可发生反应 O₂ + 4e⁻ + 2H₂O = 4OH⁻
C.图乙中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图甲、图乙中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
答案:
15. 参考答案 B
命题意图 本题以对海水中钢闸门的防腐措施为素材,考查牺牲阳极法和外加电流法的机理,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题思路 图甲中牺牲阳极一般为较活泼金属,作为原电池的负极,其失去电子被氧化。图乙中辅助阳极为惰性电极,其本身材料不失去电子,A项错误。图乙中,外加电压偏高时,钢闸门表面积累的电子过多,除了水放电外,海水中溶解的${O_{2}}$也会得电子发生还原反应,电极反应为${O_{2} + 4e^{-} + 2H_{2}O = 4OH^{-}}$,B项正确。图乙为外加电流法,腐蚀电流会随着环境的变化而变化,若外加电压保持恒定不变,则不能保证抵消腐蚀电流,不利于提高对钢闸门的防护效果,C项错误。图甲、图乙中,当钢闸门表面的腐蚀电流为零时,说明从牺牲阳极或外加电源传递过来的电子阻止了钢闸门发生腐蚀,但是牺牲阳极和辅助阳极上均发生了氧化反应,D项错误。
命题意图 本题以对海水中钢闸门的防腐措施为素材,考查牺牲阳极法和外加电流法的机理,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题思路 图甲中牺牲阳极一般为较活泼金属,作为原电池的负极,其失去电子被氧化。图乙中辅助阳极为惰性电极,其本身材料不失去电子,A项错误。图乙中,外加电压偏高时,钢闸门表面积累的电子过多,除了水放电外,海水中溶解的${O_{2}}$也会得电子发生还原反应,电极反应为${O_{2} + 4e^{-} + 2H_{2}O = 4OH^{-}}$,B项正确。图乙为外加电流法,腐蚀电流会随着环境的变化而变化,若外加电压保持恒定不变,则不能保证抵消腐蚀电流,不利于提高对钢闸门的防护效果,C项错误。图甲、图乙中,当钢闸门表面的腐蚀电流为零时,说明从牺牲阳极或外加电源传递过来的电子阻止了钢闸门发生腐蚀,但是牺牲阳极和辅助阳极上均发生了氧化反应,D项错误。
查看更多完整答案,请扫码查看


