2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. [2025·浙江1月卷,11T,3分]下列说法正确的是(
A.常温常压下${H_{2}(g)}$和${O_{2}(g)}$混合无明显现象,则反应${2H_{2}(g) + O_{2}(g)\xlongequal{}2H_{2}O(l)}$在该条件下不自发
B.${3H_{2}(g) + N_{2}(g)\xlongequal{}2NH_{3}(g)}$ $\Delta H < 0$,升高温度,平衡逆移,则反应的平衡常数减小
C.${CO(g) + H_{2}(g)\xlongequal{}C(s) + H_{2}O(g)}$ $\Delta H < 0$,则正反应的活化能大于逆反应的活化能
D.${Na(s) + \dfrac{1}{2}Cl_{2}(g)\xlongequal{}NaCl(s)}$ $\Delta H < 0$,${Na^{+}(g) + Cl^{-}(g)\xlongequal{}NaCl(s)}$ $\Delta H < 0$,则${Na(s) + \dfrac{1}{2}Cl_{2}(g)\xlongequal{}Na^{+}(g) + Cl^{-}(g)}$ $\Delta H < 0$
B
)A.常温常压下${H_{2}(g)}$和${O_{2}(g)}$混合无明显现象,则反应${2H_{2}(g) + O_{2}(g)\xlongequal{}2H_{2}O(l)}$在该条件下不自发
B.${3H_{2}(g) + N_{2}(g)\xlongequal{}2NH_{3}(g)}$ $\Delta H < 0$,升高温度,平衡逆移,则反应的平衡常数减小
C.${CO(g) + H_{2}(g)\xlongequal{}C(s) + H_{2}O(g)}$ $\Delta H < 0$,则正反应的活化能大于逆反应的活化能
D.${Na(s) + \dfrac{1}{2}Cl_{2}(g)\xlongequal{}NaCl(s)}$ $\Delta H < 0$,${Na^{+}(g) + Cl^{-}(g)\xlongequal{}NaCl(s)}$ $\Delta H < 0$,则${Na(s) + \dfrac{1}{2}Cl_{2}(g)\xlongequal{}Na^{+}(g) + Cl^{-}(g)}$ $\Delta H < 0$
答案:
1. 参考答案 B
命题意图 本题考查化学反应原理相关知识,涉及反应自发、平衡移动、反应热与活化能、盖斯定律,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路 根据$\Delta G = \Delta H - T\Delta S < 0$时,反应能够自发进行,该反应$\Delta H < 0$,$\Delta S < 0$,温度较低时该反应的$\Delta G < 0$,低温能自发进行,因常温常压下该反应的反应速率很慢,故无明显现象,A项错误。该反应为放热反应,升高温度,平衡逆移,平衡常数减小,B项正确。该反应为放热反应,则$\Delta H = E_{ 正} - E_{ 逆} < 0$,即正反应的活化能小于逆反应的活化能,C项错误。①${Na(s) + \dfrac{1}{2}Cl_{2}(g) = NaCl(s)}\ \ \Delta H_{1} < 0$,②${Na^{+}(g) + Cl^{-}(g) = NaCl(s)}\ \ \Delta H_{2} < 0$,根据盖斯定律反应①$-$反应②得到目标反应${Na(s) + \dfrac{1}{2}Cl_{2}(g) = Na^{+}(g) + Cl^{-}(g)}\ \ \Delta H$,则$\Delta H = \Delta H_{1} - \Delta H_{2}$,由于不能明确$\Delta H_{1}$、$\Delta H_{2}$相对大小,则$\Delta H$不能确定,D项错误。
命题意图 本题考查化学反应原理相关知识,涉及反应自发、平衡移动、反应热与活化能、盖斯定律,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路 根据$\Delta G = \Delta H - T\Delta S < 0$时,反应能够自发进行,该反应$\Delta H < 0$,$\Delta S < 0$,温度较低时该反应的$\Delta G < 0$,低温能自发进行,因常温常压下该反应的反应速率很慢,故无明显现象,A项错误。该反应为放热反应,升高温度,平衡逆移,平衡常数减小,B项正确。该反应为放热反应,则$\Delta H = E_{ 正} - E_{ 逆} < 0$,即正反应的活化能小于逆反应的活化能,C项错误。①${Na(s) + \dfrac{1}{2}Cl_{2}(g) = NaCl(s)}\ \ \Delta H_{1} < 0$,②${Na^{+}(g) + Cl^{-}(g) = NaCl(s)}\ \ \Delta H_{2} < 0$,根据盖斯定律反应①$-$反应②得到目标反应${Na(s) + \dfrac{1}{2}Cl_{2}(g) = Na^{+}(g) + Cl^{-}(g)}\ \ \Delta H$,则$\Delta H = \Delta H_{1} - \Delta H_{2}$,由于不能明确$\Delta H_{1}$、$\Delta H_{2}$相对大小,则$\Delta H$不能确定,D项错误。
2. [2025·北京卷,11T,3分]为理解离子化合物溶解过程的能量变化,可设想${NaCl}$固体溶于水的过程分两步实现,示意图如下。
下列说法不正确的是(
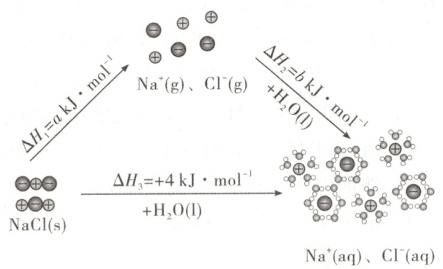
A.${NaCl}$固体溶解是吸热过程
B.根据盖斯定律可知:$a + b = 4$
C.根据各微粒的状态,可判断$a > 0$,$b > 0$
D.溶解过程的能量变化,与${NaCl}$固体和${NaCl}$溶液中微粒间作用力的强弱有关
下列说法不正确的是(
C
)
A.${NaCl}$固体溶解是吸热过程
B.根据盖斯定律可知:$a + b = 4$
C.根据各微粒的状态,可判断$a > 0$,$b > 0$
D.溶解过程的能量变化,与${NaCl}$固体和${NaCl}$溶液中微粒间作用力的强弱有关
答案:
2. 参考答案 C
命题意图 本题通过溶解过程能量变化示意图,考查盖斯定律应用与微粒间的作用力分析,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图可知,${NaCl}$固体溶解过程的焓变$\Delta H_{3} = +4\ {kJ· mol^{-1}} > 0$,为吸热过程,A项正确。结合示意图并根据盖斯定律可知$\Delta H_{3} = \Delta H_{1} + \Delta H_{2}$,即$a + b = 4$,B项正确。由图可知,${NaCl}$固体溶于水分两步实现,第一步为${NaCl}$固体变为${Na^{+}}$和${Cl^{-}}$,此过程离子键发生断裂,为吸热过程,则$a > 0$,第二步为${Na^{+}}$和${Cl^{-}}$分别与水结合形成水合钠离子和水合氯离子的过程,此过程为放热过程,则$b < 0$,C项错误。溶解过程的能量变化,取决于${NaCl}$固体断键吸收的热量及${Na^{+}}$和${Cl^{-}}$形成水合离子的过程放出的热量,即与${NaCl}$固体和${NaCl}$溶液中微粒间作用力的强弱有关,D项正确。
命题意图 本题通过溶解过程能量变化示意图,考查盖斯定律应用与微粒间的作用力分析,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图可知,${NaCl}$固体溶解过程的焓变$\Delta H_{3} = +4\ {kJ· mol^{-1}} > 0$,为吸热过程,A项正确。结合示意图并根据盖斯定律可知$\Delta H_{3} = \Delta H_{1} + \Delta H_{2}$,即$a + b = 4$,B项正确。由图可知,${NaCl}$固体溶于水分两步实现,第一步为${NaCl}$固体变为${Na^{+}}$和${Cl^{-}}$,此过程离子键发生断裂,为吸热过程,则$a > 0$,第二步为${Na^{+}}$和${Cl^{-}}$分别与水结合形成水合钠离子和水合氯离子的过程,此过程为放热过程,则$b < 0$,C项错误。溶解过程的能量变化,取决于${NaCl}$固体断键吸收的热量及${Na^{+}}$和${Cl^{-}}$形成水合离子的过程放出的热量,即与${NaCl}$固体和${NaCl}$溶液中微粒间作用力的强弱有关,D项正确。
3. [2025·云南卷,10T,3分]铜催化下,由${CO_{2}}$电合成正丙醇的关键步骤如图。下列说法正确的是(
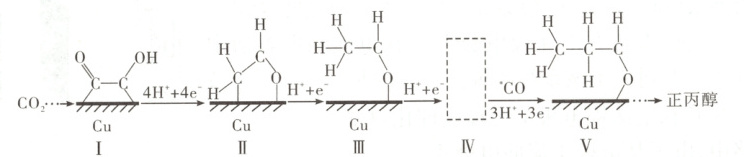
A.Ⅰ到Ⅱ的过程中发生氧化反应
B.Ⅱ到Ⅲ的过程中有非极性键生成
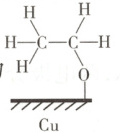
C.Ⅳ的示意图为${\overset{H}{\underset{H}{\overset{\mid}{\underset{\mid}{C}}}}\overset{H}{\underset{H}{\overset{\mid}{\underset{\mid}{C}}}}\overset{O}{\underset{Cu}{\overset{\mid}{\underset{\mid}{-}}}}$
D.催化剂${Cu}$可降低反应热
C
)
A.Ⅰ到Ⅱ的过程中发生氧化反应
B.Ⅱ到Ⅲ的过程中有非极性键生成

C.Ⅳ的示意图为${\overset{H}{\underset{H}{\overset{\mid}{\underset{\mid}{C}}}}\overset{H}{\underset{H}{\overset{\mid}{\underset{\mid}{C}}}}\overset{O}{\underset{Cu}{\overset{\mid}{\underset{\mid}{-}}}}$
D.催化剂${Cu}$可降低反应热
答案:
3. 参考答案 C
命题意图 本题通过${CO_{2}}$电合成正丙醇的机理分析,考查反应类型与催化剂作用,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路 由图可知,Ⅰ到Ⅱ的过程中得到电子,发生还原反应,A项错误。Ⅱ到Ⅲ的过程中生成了${C-H}$键,如图 有极性键生成,无非极性键生成,B项错误。II到III的过程中生成了一个${C-H}$键,则III到IV的过程中也生成了一个${C-H}$键,则IV的示意图为
有极性键生成,无非极性键生成,B项错误。II到III的过程中生成了一个${C-H}$键,则III到IV的过程中也生成了一个${C-H}$键,则IV的示意图为 ,C项正确。催化剂${Cu}$可改变活化能,加快反应速率,不能改变反应热,D项错误。
,C项正确。催化剂${Cu}$可改变活化能,加快反应速率,不能改变反应热,D项错误。
3. 参考答案 C
命题意图 本题通过${CO_{2}}$电合成正丙醇的机理分析,考查反应类型与催化剂作用,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路 由图可知,Ⅰ到Ⅱ的过程中得到电子,发生还原反应,A项错误。Ⅱ到Ⅲ的过程中生成了${C-H}$键,如图
 有极性键生成,无非极性键生成,B项错误。II到III的过程中生成了一个${C-H}$键,则III到IV的过程中也生成了一个${C-H}$键,则IV的示意图为
有极性键生成,无非极性键生成,B项错误。II到III的过程中生成了一个${C-H}$键,则III到IV的过程中也生成了一个${C-H}$键,则IV的示意图为 ,C项正确。催化剂${Cu}$可改变活化能,加快反应速率,不能改变反应热,D项错误。
,C项正确。催化剂${Cu}$可改变活化能,加快反应速率,不能改变反应热,D项错误。 4. [2025·北京卷,10T,3分]乙烯、醋酸和氧气在钯(${Pd}$)催化下高效合成醋酸乙烯酯(${CH_{2}\xlongequal{}CHOOCCH_{3}}$)的过程示意图如下。
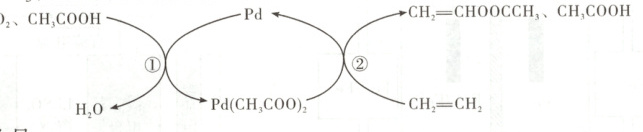
下列说法不正确的是(
A.①中反应为${4CH_{3}COOH + O_{2} + 2Pd\xrightarrow{}2Pd(CH_{3}COO)_{2} + 2H_{2}O}$
B.②中生成${CH_{2}\xlongequal{}CHOOCCH_{3}}$的过程中,有$\sigma$键断裂与形成
C.生成${CH_{2}\xlongequal{}CHOOCCH_{3}}$总反应的原子利用率为$100\%$
D.${Pd}$催化剂通过参与反应改变反应历程,提高反应速率

下列说法不正确的是(
C
)A.①中反应为${4CH_{3}COOH + O_{2} + 2Pd\xrightarrow{}2Pd(CH_{3}COO)_{2} + 2H_{2}O}$
B.②中生成${CH_{2}\xlongequal{}CHOOCCH_{3}}$的过程中,有$\sigma$键断裂与形成
C.生成${CH_{2}\xlongequal{}CHOOCCH_{3}}$总反应的原子利用率为$100\%$
D.${Pd}$催化剂通过参与反应改变反应历程,提高反应速率
答案:
4. 参考答案 C
命题意图 本题以钯催化合成醋酸乙烯酯的机理为情境,考查化学反应中的化学键变化、原子利用率等知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路 ①中反应物为${CH_{3}COOH}$、${O_{2}}$、${Pd}$,生成物为${H_{2}O}$和${Pd(CH_{3}COO)_{2}}$,反应的化学方程式为$4{CH_{3}COOH} + {O_{2}} + 2{Pd} = 2{Pd(CH_{3}COO)_{2}} + 2{H_{2}O}$,A项正确。②中生成${CH_{2}=CHOOCCH_{3}}$的过程中,有${C-H}$断裂和${C-O}$、${O-H}$的生成,存在键断裂与形成,B项正确。根据图示,总反应为${O_{2}} + 2{CH_{3}COOH} + 2{CH_{2}=CH_{2}} = 2{H_{2}O} + 2{CH_{2}=CHOOCCH_{3}}$,反应中有${H_{2}O}$生成,原子利用率小于$100\%$,C项错误。${Pd}$是反应的催化剂,参与反应改变了反应的历程,降低反应活化能,提高了反应速率,D项正确。
命题意图 本题以钯催化合成醋酸乙烯酯的机理为情境,考查化学反应中的化学键变化、原子利用率等知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路 ①中反应物为${CH_{3}COOH}$、${O_{2}}$、${Pd}$,生成物为${H_{2}O}$和${Pd(CH_{3}COO)_{2}}$,反应的化学方程式为$4{CH_{3}COOH} + {O_{2}} + 2{Pd} = 2{Pd(CH_{3}COO)_{2}} + 2{H_{2}O}$,A项正确。②中生成${CH_{2}=CHOOCCH_{3}}$的过程中,有${C-H}$断裂和${C-O}$、${O-H}$的生成,存在键断裂与形成,B项正确。根据图示,总反应为${O_{2}} + 2{CH_{3}COOH} + 2{CH_{2}=CH_{2}} = 2{H_{2}O} + 2{CH_{2}=CHOOCCH_{3}}$,反应中有${H_{2}O}$生成,原子利用率小于$100\%$,C项错误。${Pd}$是反应的催化剂,参与反应改变了反应的历程,降低反应活化能,提高了反应速率,D项正确。
查看更多完整答案,请扫码查看


