2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第36页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
14. (14分)化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO₃,进一步处理得到产品Na₂CO₃和NH₄Cl,实验流程如图:
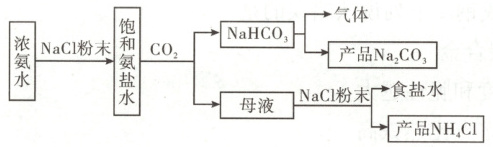
回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO₃,正确的连接顺序是
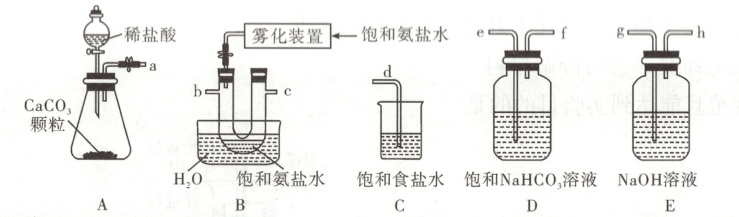
(2)B中使用雾化装置的优点是
(3)生成NaHCO₃的总反应的化学方程式为
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO₃和滤液:
①对固体NaHCO₃充分加热,产生的气体先通过足量浓硫酸,再通过足量Na₂O₂,Na₂O₂增重0.14 g,则固体NaHCO₃的质量为
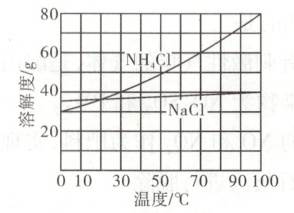
②向滤液中加入NaCl粉末,存在NaCl(s)+NH₄Cl(aq)→NaCl(aq)+NH₄Cl(s)过程。为使NH₄Cl沉淀充分析出并分离,根据NaCl和NH₄Cl溶解度曲线,需采用的操作为
(5)无水Na₂CO₃可作为基准物质标定盐酸浓度。称量前,若无水Na₂CO₃保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果
A. 偏高
B. 偏低
C. 不变

回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO₃,正确的连接顺序是
aefbcd
(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或使瓶塞上的凹槽对准分液漏斗上的小孔
。
(2)B中使用雾化装置的优点是
增大溶液与CO₂的接触面积,使CO₂被充分吸收
。(3)生成NaHCO₃的总反应的化学方程式为
NaCl + NH₃ + H₂O + CO₂ → NaHCO₃↓ + NH₄Cl
。(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO₃和滤液:
①对固体NaHCO₃充分加热,产生的气体先通过足量浓硫酸,再通过足量Na₂O₂,Na₂O₂增重0.14 g,则固体NaHCO₃的质量为
0.84
g。②向滤液中加入NaCl粉末,存在NaCl(s)+NH₄Cl(aq)→NaCl(aq)+NH₄Cl(s)过程。为使NH₄Cl沉淀充分析出并分离,根据NaCl和NH₄Cl溶解度曲线,需采用的操作为
冷却结晶
、过滤
、洗涤、干燥。
(5)无水Na₂CO₃可作为基准物质标定盐酸浓度。称量前,若无水Na₂CO₃保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果
A
(填标号)。A. 偏高
B. 偏低
C. 不变
答案:
14. 参考答案
(1) aefbcd 使瓶塞上的凹槽对准分液漏斗上的小孔
(2) 增大溶液与${CO_{2}}$的接触面积,使${CO_{2}}$被充分吸收
(3) ${NaCl + NH_{3} + H_{2}O + CO_{2}\xlongequal{}NaHCO_{3}\downarrow + NH_{4}Cl}$
(4) ①$0.84$ ②冷却结晶 过滤
(5) A
命题意图 本题考查化学实验方案的设计与实验基本操作,考查考生对化学实验知识的理解和掌握。
解题思路
(1) 实验室用A装置可制备${CO_{2}}$,经装置D可除去${CO_{2}}$中的${HCl}$杂质,将除杂后的${CO_{2}}$经b管通入饱和氨盐水中充分吸收得到${NaHCO_{3}}$,由装置B的水浴可知,该反应放热会使氨盐水中的氨水逸出,可用饱和食盐水吸收多余气体,不仅可防止空气污染,而且可得到氨盐水循环使用,即仪器正确的连接顺序为aefbcd。为使稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或使瓶塞上的凹槽对准分液漏斗上的小孔后再打开旋塞放出液体。
(2) 装置B中使用雾化装置喷洒饱和氨盐水,能增大溶液与${CO_{2}}$的接触面积,便于${CO_{2}}$充分吸收。
(3) 该图示实验中生成${NaHCO_{3}}$总反应的化学方程式为${NaCl + NH_{3} + H_{2}O + CO_{2}\xlongequal{}NaHCO_{3}\downarrow + NH_{4}Cl}$。
(4) ①结合${2NaHCO_{3}\xlongequal{\Delta}Na_{2}CO_{3} + CO_{2}\uparrow + H_{2}O}$和${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$可找出关系式,并结合差量法得:
${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$ $\Delta m$
$2\ mol$ $56\ g$
$n({Na_{2}O_{2}})$ $0.14\ g$
解得$n({Na_{2}O_{2}}) = 5× 10^{-3}\ mol$。$n({NaHCO_{3}}) = 2n({Na_{2}O_{2}}) = 1× 10^{-2}\ mol$,$m({NaHCO_{3}}) = 1× 10^{-2}\ mol× 84\ g· mol^{-1} = 0.84\ g$。
②结合溶解度曲线可知,${NH_{4}Cl}$的溶解度受温度影响变化比较大,而${NaCl}$的溶解度受温度影响变化不大,故可采用冷却结晶的方法使${NH_{4}Cl}$充分析出,再经过过滤、洗涤和干燥得到${NH_{4}Cl}$沉淀。
(5) 实验标定一定体积的盐酸浓度时,由于无水${Na_{2}CO_{3}}$保存不当,吸收一定量水分,会使标准液的物质的量浓度偏低,标定过程中消耗${Na_{2}CO_{3}}$的体积偏大,由$c( 待测) = \dfrac{2c( 标准)× V( 标准)}{V( 待测)}$可知,实验测得盐酸的浓度偏高。
思路拓展
在侯氏制碱法中,由于${NH_{3}}$极易溶于水,而${CO_{2}}$的溶解度较小,需要先向饱和食盐水中通入${NH_{3}}$,或向浓氨水中加入${NaCl}$粉末制成饱和氨盐水,再通入${CO_{2}}$,即可制得${NaHCO_{3}}$沉淀,将${NaHCO_{3}}$过滤后再经热分解制得纯碱。
(1) aefbcd 使瓶塞上的凹槽对准分液漏斗上的小孔
(2) 增大溶液与${CO_{2}}$的接触面积,使${CO_{2}}$被充分吸收
(3) ${NaCl + NH_{3} + H_{2}O + CO_{2}\xlongequal{}NaHCO_{3}\downarrow + NH_{4}Cl}$
(4) ①$0.84$ ②冷却结晶 过滤
(5) A
命题意图 本题考查化学实验方案的设计与实验基本操作,考查考生对化学实验知识的理解和掌握。
解题思路
(1) 实验室用A装置可制备${CO_{2}}$,经装置D可除去${CO_{2}}$中的${HCl}$杂质,将除杂后的${CO_{2}}$经b管通入饱和氨盐水中充分吸收得到${NaHCO_{3}}$,由装置B的水浴可知,该反应放热会使氨盐水中的氨水逸出,可用饱和食盐水吸收多余气体,不仅可防止空气污染,而且可得到氨盐水循环使用,即仪器正确的连接顺序为aefbcd。为使稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或使瓶塞上的凹槽对准分液漏斗上的小孔后再打开旋塞放出液体。
(2) 装置B中使用雾化装置喷洒饱和氨盐水,能增大溶液与${CO_{2}}$的接触面积,便于${CO_{2}}$充分吸收。
(3) 该图示实验中生成${NaHCO_{3}}$总反应的化学方程式为${NaCl + NH_{3} + H_{2}O + CO_{2}\xlongequal{}NaHCO_{3}\downarrow + NH_{4}Cl}$。
(4) ①结合${2NaHCO_{3}\xlongequal{\Delta}Na_{2}CO_{3} + CO_{2}\uparrow + H_{2}O}$和${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$可找出关系式,并结合差量法得:
${2Na_{2}O_{2} + 2CO_{2}\xlongequal{}2Na_{2}CO_{3} + O_{2}}$ $\Delta m$
$2\ mol$ $56\ g$
$n({Na_{2}O_{2}})$ $0.14\ g$
解得$n({Na_{2}O_{2}}) = 5× 10^{-3}\ mol$。$n({NaHCO_{3}}) = 2n({Na_{2}O_{2}}) = 1× 10^{-2}\ mol$,$m({NaHCO_{3}}) = 1× 10^{-2}\ mol× 84\ g· mol^{-1} = 0.84\ g$。
②结合溶解度曲线可知,${NH_{4}Cl}$的溶解度受温度影响变化比较大,而${NaCl}$的溶解度受温度影响变化不大,故可采用冷却结晶的方法使${NH_{4}Cl}$充分析出,再经过过滤、洗涤和干燥得到${NH_{4}Cl}$沉淀。
(5) 实验标定一定体积的盐酸浓度时,由于无水${Na_{2}CO_{3}}$保存不当,吸收一定量水分,会使标准液的物质的量浓度偏低,标定过程中消耗${Na_{2}CO_{3}}$的体积偏大,由$c( 待测) = \dfrac{2c( 标准)× V( 标准)}{V( 待测)}$可知,实验测得盐酸的浓度偏高。
思路拓展
在侯氏制碱法中,由于${NH_{3}}$极易溶于水,而${CO_{2}}$的溶解度较小,需要先向饱和食盐水中通入${NH_{3}}$,或向浓氨水中加入${NaCl}$粉末制成饱和氨盐水,再通入${CO_{2}}$,即可制得${NaHCO_{3}}$沉淀,将${NaHCO_{3}}$过滤后再经热分解制得纯碱。
查看更多完整答案,请扫码查看


