2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第89页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
9. [2025·湖北卷,15T,3 分]某电化学制冷系统的装置如图所示。[Fe(H₂O)₆]³⁺和[Fe(H₂O)₆]²⁺在电极上发生相互转化,伴随着热量的吸收或释放,经由泵推动电解质溶液的循环流动(①→②→③→④→①)实现制冷。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,其他区域绝热。下列描述错误的是(
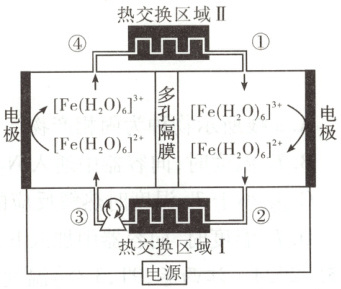
A.阴极反应为[Fe(H₂O)₆]³⁺ + e⁻ = [Fe(H₂O)₆]²⁺
B.已知②处的电解液温度比①处的低,可推断[Fe(H₂O)₆]²⁺比[Fe(H₂O)₆]³⁺稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自电子转移后[Fe(H₂O)₆]²⁺和[Fe(H₂O)₆]³⁺离子结构的改变
B
)
A.阴极反应为[Fe(H₂O)₆]³⁺ + e⁻ = [Fe(H₂O)₆]²⁺
B.已知②处的电解液温度比①处的低,可推断[Fe(H₂O)₆]²⁺比[Fe(H₂O)₆]³⁺稳定
C.多孔隔膜可以阻止阴极区和阳极区间的热交换
D.已知电子转移过程非常快,物质结构来不及改变。热效应主要来自电子转移后[Fe(H₂O)₆]²⁺和[Fe(H₂O)₆]³⁺离子结构的改变
答案:
9. 参考答案 B
命题意图 本题通过电化学制冷系统分析,考查电极反应与能量转换,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图可知,左侧为阳极,电极反应为${[Fe(H_{2}O)_{6}]^{2+} - e^{-} = [Fe(H_{2}O)_{6}]^{3+}}$,右侧电极为阴极,电极反应为${[Fe(H_{2}O)_{6}]^{3+} + e^{-} = [Fe(H_{2}O)_{6}]^{2+}}$。A项正确。已知②处的电解液温度比①处的低,则可推断${[Fe(H_{2}O)_{6}]^{3+}}$转化为${[Fe(H_{2}O)_{6}]^{2+}}$是吸热反应,则${[Fe(H_{2}O)_{6}]^{3+}}$的能量相对更低,更稳定,B项错误。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,多孔隔膜可以阻止两电极区的溶液对流,从而阻止热交换,C项正确。根据题中信息与电极反应可知,热效应主要与${[Fe(H_{2}O)_{6}]^{2+}}$和${[Fe(H_{2}O)_{6}]^{3+}}$的离子结构变化有关,D项正确。
命题意图 本题通过电化学制冷系统分析,考查电极反应与能量转换,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图可知,左侧为阳极,电极反应为${[Fe(H_{2}O)_{6}]^{2+} - e^{-} = [Fe(H_{2}O)_{6}]^{3+}}$,右侧电极为阴极,电极反应为${[Fe(H_{2}O)_{6}]^{3+} + e^{-} = [Fe(H_{2}O)_{6}]^{2+}}$。A项正确。已知②处的电解液温度比①处的低,则可推断${[Fe(H_{2}O)_{6}]^{3+}}$转化为${[Fe(H_{2}O)_{6}]^{2+}}$是吸热反应,则${[Fe(H_{2}O)_{6}]^{3+}}$的能量相对更低,更稳定,B项错误。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,多孔隔膜可以阻止两电极区的溶液对流,从而阻止热交换,C项正确。根据题中信息与电极反应可知,热效应主要与${[Fe(H_{2}O)_{6}]^{2+}}$和${[Fe(H_{2}O)_{6}]^{3+}}$的离子结构变化有关,D项正确。
10. [2025·北京卷,14T,3 分]用电解 Na₂SO₄溶液(图甲)后的石墨电极 1、2 探究氢氧燃料电池,重新取 Na₂SO₄溶液并用图乙装置按 i→iv 顺序依次完成实验。
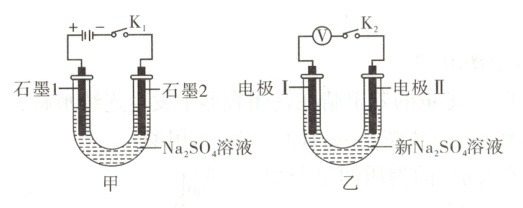
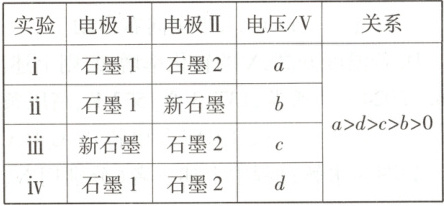
下列分析不正确的是(
A.a>0,说明实验 i 中形成原电池,反应为 2H₂ + O₂ = 2H₂O
B.b<d,是因为 ii 中电极Ⅱ上缺少 H₂作为还原剂
C.c>0,说明 iii 中电极Ⅰ上有 O₂发生反应
D.d>c,是因为电极Ⅰ上吸附 H₂的量:iv>iii


下列分析不正确的是(
D
)A.a>0,说明实验 i 中形成原电池,反应为 2H₂ + O₂ = 2H₂O
B.b<d,是因为 ii 中电极Ⅱ上缺少 H₂作为还原剂
C.c>0,说明 iii 中电极Ⅰ上有 O₂发生反应
D.d>c,是因为电极Ⅰ上吸附 H₂的量:iv>iii
答案:
10. 参考答案 D
命题意图 本题以氢氧燃料电池的电极探究实验为背景,考查原电池原理的理解与应用,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路 按照图甲装置电解${Na_{2}SO_{4}}$溶液,石墨1为阳极,发生反应${2H_{2}O - 4e^{-} = O_{2}\uparrow + 4H^{+}}$,石墨1中会吸附${O_{2}}$;石墨2为阴极,发生反应${2H_{2}O + 2e^{-} = H_{2}\uparrow + 2OH^{-}}$,石墨2中会吸附${H_{2}}$。实验ⅰ会形成原电池,$a > 0$,则图乙中电极Ⅰ上氧气发生还原反应,为正极,电极Ⅱ上氢气发生氧化反应,为负极,电池总反应为${2H_{2} + O_{2} = 2H_{2}O}$,A项正确。实验ⅱ中电极Ⅱ为新石墨,相比于石墨2,缺少${H_{2}}$作为还原剂,故导致$b < d$,B项正确。实验ⅲ的$c > 0$,新石墨可能吸附空气中的少量${O_{2}}$,即ⅲ中电极Ⅰ上有${O_{2}}$发生反应,C项正确。实验ⅲ与实验ⅳ中电极Ⅰ不同,实验ⅳ中石墨1电极上吸附${O_{2}}$的量远大于实验ⅲ中的新石墨电极,使得电压$d > c$,由于实验ⅳ在实验ⅲ之后进行,故电极Ⅱ上吸附${H_{2}}$的量ⅳ$ < $ⅲ,D项错误。
命题意图 本题以氢氧燃料电池的电极探究实验为背景,考查原电池原理的理解与应用,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路 按照图甲装置电解${Na_{2}SO_{4}}$溶液,石墨1为阳极,发生反应${2H_{2}O - 4e^{-} = O_{2}\uparrow + 4H^{+}}$,石墨1中会吸附${O_{2}}$;石墨2为阴极,发生反应${2H_{2}O + 2e^{-} = H_{2}\uparrow + 2OH^{-}}$,石墨2中会吸附${H_{2}}$。实验ⅰ会形成原电池,$a > 0$,则图乙中电极Ⅰ上氧气发生还原反应,为正极,电极Ⅱ上氢气发生氧化反应,为负极,电池总反应为${2H_{2} + O_{2} = 2H_{2}O}$,A项正确。实验ⅱ中电极Ⅱ为新石墨,相比于石墨2,缺少${H_{2}}$作为还原剂,故导致$b < d$,B项正确。实验ⅲ的$c > 0$,新石墨可能吸附空气中的少量${O_{2}}$,即ⅲ中电极Ⅰ上有${O_{2}}$发生反应,C项正确。实验ⅲ与实验ⅳ中电极Ⅰ不同,实验ⅳ中石墨1电极上吸附${O_{2}}$的量远大于实验ⅲ中的新石墨电极,使得电压$d > c$,由于实验ⅳ在实验ⅲ之后进行,故电极Ⅱ上吸附${H_{2}}$的量ⅳ$ < $ⅲ,D项错误。
11. [2025·浙江 1 月卷,12T,3 分]一种可充放电 Li-O₂电池的结构示意图如图所示。该电池放电时,产物为 Li₂O 和 Li₂O₂,随温度升高 Q(消耗 1 mol O₂转移的电子数)增大。下列说法不正确的是(
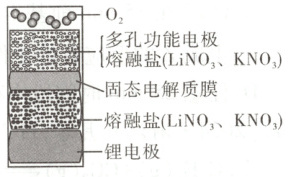
A.熔融盐中 LiNO₃的物质的量分数影响充放电速率
B.充放电时,Li⁺优先于 K⁺通过固态电解质膜
C.放电时,随温度升高 Q 增大,是因为正极区 O²⁻转化为 O₂²⁻
D.充电时,锂电极接电源负极
C
)
A.熔融盐中 LiNO₃的物质的量分数影响充放电速率
B.充放电时,Li⁺优先于 K⁺通过固态电解质膜
C.放电时,随温度升高 Q 增大,是因为正极区 O²⁻转化为 O₂²⁻
D.充电时,锂电极接电源负极
答案:
11. 参考答案 C
命题意图 本题以一种可充电${Li - O_{2}}$电池为情境,意在考生考查对电化学知识的理解与灵活迁移应用能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 ${Li^{+}}$比${K^{+}}$的半径小,因此${Li^{+}}$优先于${K^{+}}$通过固态电解质膜,且充电时有${Li^{+}}$参与,因此熔融盐中${LiNO_{3}}$的物质的量分数越大,导电性越好,充放电速率越高,A、B项均正确。放电时,正极上${O_{2}}$得到电子,${O_{2}}$转化为${O^{2-}}$比转化为${O^{2-}_{2}}$转移的电子多,故放电时,随温度升高$Q$增大,正极区${O^{2-}_{2}}$转化为${O^{2-}}$,C项错误。充电时,锂电极为阴极,应接电源负极,D项正确。
命题意图 本题以一种可充电${Li - O_{2}}$电池为情境,意在考生考查对电化学知识的理解与灵活迁移应用能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 ${Li^{+}}$比${K^{+}}$的半径小,因此${Li^{+}}$优先于${K^{+}}$通过固态电解质膜,且充电时有${Li^{+}}$参与,因此熔融盐中${LiNO_{3}}$的物质的量分数越大,导电性越好,充放电速率越高,A、B项均正确。放电时,正极上${O_{2}}$得到电子,${O_{2}}$转化为${O^{2-}}$比转化为${O^{2-}_{2}}$转移的电子多,故放电时,随温度升高$Q$增大,正极区${O^{2-}_{2}}$转化为${O^{2-}}$,C项错误。充电时,锂电极为阴极,应接电源负极,D项正确。
12. [2024·江西卷,11T,3 分]我国学者发明了一种新型多功能甲醛-硝酸盐电池,可同时处理废水中的甲醛和硝酸根离子(如图)。下列说法正确的是(
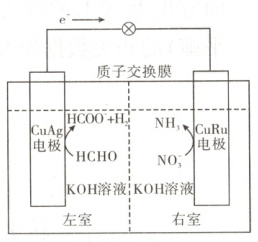
A.CuAg 电极反应为 2HCHO + 2H₂O - 4e⁻ = 2HCOO⁻ + H₂↑ + 2OH⁻
B.CuRu 电极反应为 NO₃⁻ + 6H₂O + 8e⁻ = NH₃↑ + 9OH⁻
C.放电过程中,OH⁻通过质子交换膜从左室传递到右室
D.处理废水过程中溶液 pH 不变,无需补加 KOH
B
)
A.CuAg 电极反应为 2HCHO + 2H₂O - 4e⁻ = 2HCOO⁻ + H₂↑ + 2OH⁻
B.CuRu 电极反应为 NO₃⁻ + 6H₂O + 8e⁻ = NH₃↑ + 9OH⁻
C.放电过程中,OH⁻通过质子交换膜从左室传递到右室
D.处理废水过程中溶液 pH 不变,无需补加 KOH
答案:
12. 参考答案 B
命题意图 本题以甲醛$-$硝酸盐电池为素材,涉及电极反应、离子移动方向、总反应等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 根据甲醛$-$硝酸盐电池工作时电子移动方向可知,${CuAg}$电极为负极,${CuRu}$电极为正极,负极上${HCHO}$失电子生成${HCOO^{-}}$和${H_{2}}$,正极上${NO^{-}_{3}}$得电子生成${NH_{3}}$。${CuAg}$电极为负极,负极电极反应为${2HCHO + 4OH^{-} - 2e^{-} = 2HCOO^{-} + H_{2}\uparrow + 2H_{2}O}$,A项错误。${CuRu}$电极为正极,正极电极反应为${NO^{-}_{3} + 6H_{2}O + 8e^{-} = NH_{3}\uparrow + 9OH^{-}}$,B项正确。质子交换膜只允许${H^{+}}$通过,不允许${OH^{-}}$通过,C项错误。同时处理废水中的甲醛和硝酸根离子的总反应为${8HCHO + NO^{-}_{3} + 7OH^{-} = 8HCOO^{-} + 4H_{2}\uparrow + NH_{3}\uparrow + 2H_{2}O}$,处理废水过程中消耗${KOH}$溶液且生成${H_{2}O}$,溶液${pH}$降低,故需补加${KOH}$,D项错误。
命题意图 本题以甲醛$-$硝酸盐电池为素材,涉及电极反应、离子移动方向、总反应等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 根据甲醛$-$硝酸盐电池工作时电子移动方向可知,${CuAg}$电极为负极,${CuRu}$电极为正极,负极上${HCHO}$失电子生成${HCOO^{-}}$和${H_{2}}$,正极上${NO^{-}_{3}}$得电子生成${NH_{3}}$。${CuAg}$电极为负极,负极电极反应为${2HCHO + 4OH^{-} - 2e^{-} = 2HCOO^{-} + H_{2}\uparrow + 2H_{2}O}$,A项错误。${CuRu}$电极为正极,正极电极反应为${NO^{-}_{3} + 6H_{2}O + 8e^{-} = NH_{3}\uparrow + 9OH^{-}}$,B项正确。质子交换膜只允许${H^{+}}$通过,不允许${OH^{-}}$通过,C项错误。同时处理废水中的甲醛和硝酸根离子的总反应为${8HCHO + NO^{-}_{3} + 7OH^{-} = 8HCOO^{-} + 4H_{2}\uparrow + NH_{3}\uparrow + 2H_{2}O}$,处理废水过程中消耗${KOH}$溶液且生成${H_{2}O}$,溶液${pH}$降低,故需补加${KOH}$,D项错误。
查看更多完整答案,请扫码查看


