2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
16.(14分)闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物
铜包钢的有效分离,同时得到的CuCI可用于催化、医药、冶金等重要领域。工艺流程如图所示:
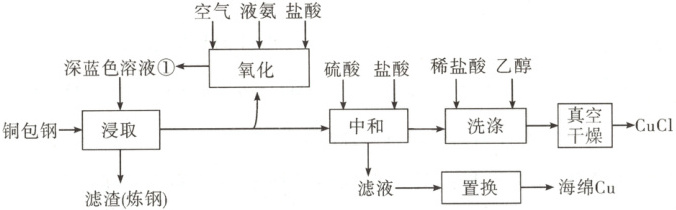
已知:室温下的Ks(CuCl)=10−6.8。
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为
(填化学式)。
(2)滤渣的主要成分为
(3)浸取工序的产物为[Cu(NH;)2]CI,该工序发生反应的化学方程式为
化工序发生反应的离子方程式为
(4)浸取工序宜在30~40℃进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸
取的原因是
(5)补全中和工序中主反应的离子方程式[Cu(NH)2]++2H++CI−=
(6)真空干燥的目的为
铜包钢的有效分离,同时得到的CuCI可用于催化、医药、冶金等重要领域。工艺流程如图所示:

已知:室温下的Ks(CuCl)=10−6.8。
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为
[Cu(NH3)4]Cl2
(填化学式)。
(2)滤渣的主要成分为
Fe
(填化学式)。(3)浸取工序的产物为[Cu(NH;)2]CI,该工序发生反应的化学方程式为
[Cu(NH3)4]Cl2+Cu=2[Cu(NH3)2]Cl
。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为
8NH3+4[Cu(NH3)2]++O2+4H+=4[Cu(NH3)4]2++2H2O
。(4)浸取工序宜在30~40℃进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸
取的原因是
盐酸和液氨反应放热
。(5)补全中和工序中主反应的离子方程式[Cu(NH)2]++2H++CI−=
CuCl↓
+2NH4+
。(6)真空干燥的目的为
防止干燥过程中CuCl被空气中的O2氧化
。
答案:
16. 参考答案
(1)$[ Cu(NH_3 )_4] Cl_2$
(2)$ Fe$
(3)$[ Cu(NH_3 )_4] Cl_2+ Cu=2[ Cu(NH_3 )_2] Cl$ $8 NH_3+4[ Cu(NH_3 )_2]^++ O_2+4 H^+=4[ Cu(NH_3 )_4]^{2+}+2 H_2 O$
(4)盐酸和液氨反应放热
(5)$ CuCl\downarrow+2 NH_4^+$
(6)防止干燥过程中$ CuCl$被空气中的$ O_2$氧化
命题意图 本题考查化学工艺流程,意在考查考生对工艺流程的分析能力与知识迁移能力,体现了“科学态度与社会责任”“证据推理与模型认知”化学学科核心素养。
解题思路
 通入空气的目的是用氧气氧化亚铜离子
通入空气的目的是用氧气氧化亚铜离子
(1)分析流程图可知,首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,主要物质成分呈现深蓝色,可判断其阳离子为$[ Cu(NH_3 )_4]^{2+}$,由元素守恒可知,其阴离子为$ Cl^-$,因此深蓝色溶液①为$[ Cu(NH_3 )_4] Cl_2$溶液。
(2)铜包钢的外层为铜镀层,经过第一步处理,铜被氧化后转化为$[ Cu(NH_3 )_2]^+$进入溶液,铁仍为固体,且流程图中明确指出,固体残渣的主要用途为炼钢,指向很明确,可判断固体滤渣的主要成分为$ Fe$。
(3)从流程图浸取工序给出的信息分析,反应物为$ Cu$和深蓝色溶液①$[ Cu(NH_3 )_4] Cl_2$,产物为$[ Cu(NH_3 )_2] Cl$,反应物和产物成分明确,根据电子守恒和质量守恒可写出反应的化学方程式。浸取后滤液的一部分经氧化工序可得深蓝色溶液①,从流程图氧化工序提供的信息可知,反应物涉及$[ Cu(NH_3 )_2] Cl$、$ H^+$、$ O_2$和$ NH_3$,产物明确为$[ Cu(NH_3 )_4] Cl_2$,结合反应物中$ H^+$、$ O_2$的共同存在,可以判断氧化还原反应有$ H_2 O$生成,反应的离子方程式为$8 NH_3+4[ Cu(NH_3 )_2]^++ O_2+4 H^+=4[ Cu(NH_3 )_4]^{2+}+2 H_2 O$。
(4)$[ Cu(NH_3 )_4]^{2+}$的再生反应的原料为盐酸与液氨,二者反应生成氯化铵和水为典型的酸碱中和放热反应,反应放出的热量可以维持浸取工序的进行,所以当环境温度较低时,浸取液再生后不需要额外加热即可进行浸取。
(5)从流程图中可以看出,中和工序后的主要步骤是洗涤和干燥,无进一步化学反应发生,说明中和工序后$ CuCl$已经析出,根据元素守恒、电荷守恒可以确定产物为$ CuCl$、$ NH_4^+$,反应的离子方程式为$[ Cu(NH_3 )_2]^++2 H^++ Cl^-= CuCl\downarrow+2 NH_4^+$。
(6)铜元素在化合物中的常见价态有+1和+2。溶液或湿润状态下,+2价铜化合物比+1价铜化合物更稳定。产品$ CuCl$中铜为+1价,湿润状态下易被氧化。中和后得到的产物$ CuCl$经过洗涤后,仍会含有少量水分,若常压下热风干燥,会被空气氧化为+2价铜化合物。要避免干燥过程中遇到氧气,一般会采用真空干燥。
16. 参考答案
(1)$[ Cu(NH_3 )_4] Cl_2$
(2)$ Fe$
(3)$[ Cu(NH_3 )_4] Cl_2+ Cu=2[ Cu(NH_3 )_2] Cl$ $8 NH_3+4[ Cu(NH_3 )_2]^++ O_2+4 H^+=4[ Cu(NH_3 )_4]^{2+}+2 H_2 O$
(4)盐酸和液氨反应放热
(5)$ CuCl\downarrow+2 NH_4^+$
(6)防止干燥过程中$ CuCl$被空气中的$ O_2$氧化
命题意图 本题考查化学工艺流程,意在考查考生对工艺流程的分析能力与知识迁移能力,体现了“科学态度与社会责任”“证据推理与模型认知”化学学科核心素养。
解题思路
 通入空气的目的是用氧气氧化亚铜离子
通入空气的目的是用氧气氧化亚铜离子(1)分析流程图可知,首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,主要物质成分呈现深蓝色,可判断其阳离子为$[ Cu(NH_3 )_4]^{2+}$,由元素守恒可知,其阴离子为$ Cl^-$,因此深蓝色溶液①为$[ Cu(NH_3 )_4] Cl_2$溶液。
(2)铜包钢的外层为铜镀层,经过第一步处理,铜被氧化后转化为$[ Cu(NH_3 )_2]^+$进入溶液,铁仍为固体,且流程图中明确指出,固体残渣的主要用途为炼钢,指向很明确,可判断固体滤渣的主要成分为$ Fe$。
(3)从流程图浸取工序给出的信息分析,反应物为$ Cu$和深蓝色溶液①$[ Cu(NH_3 )_4] Cl_2$,产物为$[ Cu(NH_3 )_2] Cl$,反应物和产物成分明确,根据电子守恒和质量守恒可写出反应的化学方程式。浸取后滤液的一部分经氧化工序可得深蓝色溶液①,从流程图氧化工序提供的信息可知,反应物涉及$[ Cu(NH_3 )_2] Cl$、$ H^+$、$ O_2$和$ NH_3$,产物明确为$[ Cu(NH_3 )_4] Cl_2$,结合反应物中$ H^+$、$ O_2$的共同存在,可以判断氧化还原反应有$ H_2 O$生成,反应的离子方程式为$8 NH_3+4[ Cu(NH_3 )_2]^++ O_2+4 H^+=4[ Cu(NH_3 )_4]^{2+}+2 H_2 O$。
(4)$[ Cu(NH_3 )_4]^{2+}$的再生反应的原料为盐酸与液氨,二者反应生成氯化铵和水为典型的酸碱中和放热反应,反应放出的热量可以维持浸取工序的进行,所以当环境温度较低时,浸取液再生后不需要额外加热即可进行浸取。
(5)从流程图中可以看出,中和工序后的主要步骤是洗涤和干燥,无进一步化学反应发生,说明中和工序后$ CuCl$已经析出,根据元素守恒、电荷守恒可以确定产物为$ CuCl$、$ NH_4^+$,反应的离子方程式为$[ Cu(NH_3 )_2]^++2 H^++ Cl^-= CuCl\downarrow+2 NH_4^+$。
(6)铜元素在化合物中的常见价态有+1和+2。溶液或湿润状态下,+2价铜化合物比+1价铜化合物更稳定。产品$ CuCl$中铜为+1价,湿润状态下易被氧化。中和后得到的产物$ CuCl$经过洗涤后,仍会含有少量水分,若常压下热风干燥,会被空气氧化为+2价铜化合物。要避免干燥过程中遇到氧气,一般会采用真空干燥。
17.(15分)氮是自然界重要元素之一,研究氮及其化合物的性质以及氮的循环利用对解决环境和
能源问题都具有重要意义。
已知:1mol物质中的化学键断裂时所需能量如表。

回答下列问题:
(1)恒温下,将1mol空气(N2和02的体积分数分别为0.78和0.21,其余为惰性组分)置于容
积为VL的恒容密闭容器中,假设体系中只存在如下两个反应:
i.N2(g)+O2(g)2NO(g) KAH
ii.2NO(g)+O2(g)12NO2(g) K2△H2=−114kJ.mo1−1
①△H1=
②以下操作可以降低上述平衡体系中NO浓度的有
A.缩小体积 B.升高温度
C.移除NO2 D.降低N2浓度
③若上述平衡体系中c(NO2)=amol1.L−,c(NO)=bmol.L−,则c(O22)=
(2)氢气催化还原NO作为一种高效环保的脱硝技术备受关注。高温下氢气还原NO反应的速
率方程为v=kc(NO)c(H2),k为速率常数。在一定温度下改变体系中各物质浓度,测定结
果如表。
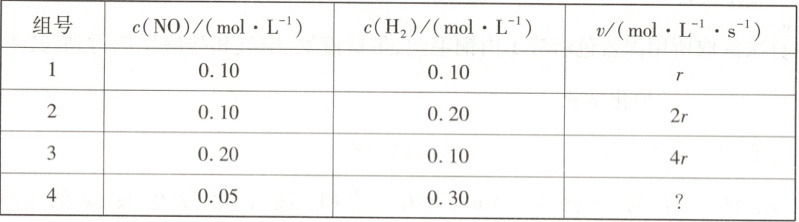
表中第4组的反应速率为
(3)①以空气中的氮气为原料电解合成氨时,N2在
应,产生NH3。
②氨燃料电池和氢燃料电池产生相同电量时,理论上消耗NH,和H2的质量比为17:3,则在
碱性介质中氨燃料电池负极的电极反应式为
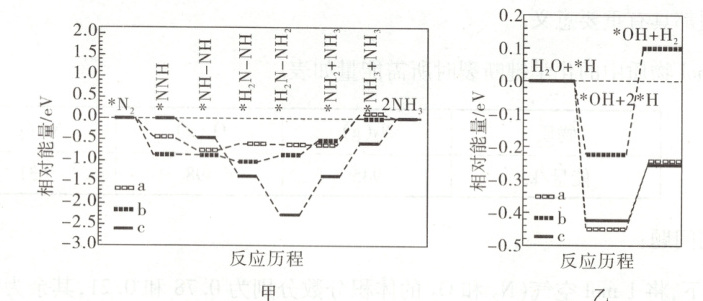
③我国科学家研究了水溶液中三种催化剂(a、b、c)上N2电还原为NH(图甲)和H2O电还
原为H(图乙)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强
到弱的顺序为
能源问题都具有重要意义。
已知:1mol物质中的化学键断裂时所需能量如表。

回答下列问题:
(1)恒温下,将1mol空气(N2和02的体积分数分别为0.78和0.21,其余为惰性组分)置于容
积为VL的恒容密闭容器中,假设体系中只存在如下两个反应:
i.N2(g)+O2(g)2NO(g) KAH
ii.2NO(g)+O2(g)12NO2(g) K2△H2=−114kJ.mo1−1
①△H1=
+181
kJ.mol−。②以下操作可以降低上述平衡体系中NO浓度的有
CD
(填标号)。A.缩小体积 B.升高温度
C.移除NO2 D.降低N2浓度
③若上述平衡体系中c(NO2)=amol1.L−,c(NO)=bmol.L−,则c(O22)=
$\frac{0.21}{V}-\frac{2a+b}{2}$
mol.L,K=$\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$
(写出含a、b、V的计算式)。(2)氢气催化还原NO作为一种高效环保的脱硝技术备受关注。高温下氢气还原NO反应的速
率方程为v=kc(NO)c(H2),k为速率常数。在一定温度下改变体系中各物质浓度,测定结
果如表。

表中第4组的反应速率为
0.75r
(写出含r的表达式)mol.L.s−。(3)①以空气中的氮气为原料电解合成氨时,N2在
阴
(填“阴”或“阳”)极上发生反应,产生NH3。
②氨燃料电池和氢燃料电池产生相同电量时,理论上消耗NH,和H2的质量比为17:3,则在
碱性介质中氨燃料电池负极的电极反应式为
2NH3-6e-+6OH-=N2+6H2O
。③我国科学家研究了水溶液中三种催化剂(a、b、c)上N2电还原为NH(图甲)和H2O电还
原为H(图乙)反应历程中的能量变化,则三种催化剂对N2电还原为NH3的催化活性由强
到弱的顺序为
bac
(用字母a、b、c排序)。
答案:
17. 参考答案
(1)①+181 ②CD ③$\frac{0.21}{V}-\frac{2a+b}{2}$ $\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$
(2)0.75r
(3)①阴 ②$2 NH_3-6 e^-+6 OH^-= N_2+6 H_2 O$ ③bac
命题意图 本题考查化学反应原理,意在考查考生的理解分析能力,体现了“变化观念与平衡思想”“证据推理与模型认知”化学学科核心素养。
解题思路
(1)①$\Delta H_1=$反应物总键能-生成物总键能$=(945\ kJ· mol^{-1}+498\ kJ· mol^{-1})-2×631\ kJ· mol^{-1}=+181\ kJ· mol^{-1}$。
②缩小体积,所有物质浓度均增大,A项错误。升高温度,平衡向放热方向进行,反应ⅰ为吸热反应,反应ⅱ为放热反应,则升高温度,反应ⅰ正向移动,反应ⅱ逆向移动,$ NO$浓度增大,B项错误。移除$ NO_2$,反应ⅱ的平衡正向进行,$ NO$浓度降低,C项正确。降低$ N_2$浓度,平衡逆向进行,消耗$ NO$,$ NO$浓度降低,D项正确。
③方法一:守恒法计算
初始时,将1 mol空气置于容积为$V\ L$的恒容密闭容器中,$c( O_2)=\frac{0.21}{V}\ mol· L^{-1}$,$c( N_2)=\frac{0.78}{V}\ mol· L^{-1}$。平衡体系中,含有$ N_2\ b\ mol· L^{-1}$、$ NO\ a\ mol· L^{-1}$、$ NO_2$,由$ N$元素守恒可知,平衡时$c( N_2)=(\frac{0.78}{V}-\frac{a+b}{2})\ mol· L^{-1}$;同理,$ NO_2$分子中含有2个$ O$原子,$ NO$分子中含有1个$ O$原子,$ NO_2$和$ NO$中的$ O$原子全部来自$ O_2$,则反应中$c_{ 消耗}( O_2)=\frac{2a+b}{2}\ mol· L^{-1}$,根据氧原子守恒可知,平衡时,体系中$c( O_2)=(\frac{0.21}{V}-\frac{2a+b}{2})\ mol· L^{-1}$,$K_1=\frac{c^2( NO)}{c( N_2)· c( O_2)}=\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$。
方法二:“三段式”法计算
$ NO$在反应ⅰ中生成,反应ⅱ中消耗。$ NO$在反应ⅱ中的生成浓度=平衡浓度+反应ⅱ中的消耗浓度$=(a+b)\ mol· L^{-1}$。
反应ⅰ中$ O_2$的消耗浓度为$\frac{a+b}{2}\ mol· L^{-1}$,反应ⅱ中$ O_2$的消耗浓度为$\frac{a}{2}\ mol· L^{-1}$,平衡时体系中$ O_2$的浓度为$(\frac{0.21}{V}-\frac{2a+b}{2})\ mol· L^{-1}$。$ N_2$只参与了反应ⅰ,其在反应ⅰ中消耗的浓度为$\frac{a+b}{2}\ mol· L^{-1}$,平衡时体系中$ N_2$的浓度为$(\frac{0.78}{V}-\frac{a+b}{2})\ mol· L^{-1}$,$K_1=\frac{c^2( NO)}{c( N_2)· c( O_2)}=\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$。
(2)实验1与实验2相比,$\frac{r}{2r}=\frac{k(0.10)^x(0.10)^y}{k(0.10)^x(0.20)^y}$,$y=1$,实验1与实验3相比,$\frac{r}{4r}=\frac{k(0.10)^x(0.10)^y}{k(0.20)^x(0.10)^y}$,$x=2$,实验1与实验4相比,$\frac{r}{v_4}=\frac{k(0.10)^2(0.10)}{k(0.05)^2(0.30)}$,$v_4=0.75r$。
(3)①$ N_2$生成$ NH_3$,化合价降低,得电子,发生还原反应,则$ N_2$在阴极反应产生$ NH_3$。
②氨燃料电池和氢燃料电池产生相同电量时,理论上消耗$ NH_3$和$ H_2$的质量比为17:3,可得出$ NH_3$和$ H_2$的物质的量之比为2:3,即2 mol $ NH_3$失去电子数与3 mol $ H_2$失去电子数相等。所以2 mol $ NH_3$共失去6 mol电子,氮元素的化合价从-3升高到0,产物应为$ N_2$。在碱性下发生的负极电极反应式为$2 NH_3-6 e^-+6 OH^-= N_2+6 H_2 O$。
③由题中信息可知,三种催化剂上都存在一对竞争反应:$ N_2$电还原为$ NH_3$和$ H_2 O$电还原为$ H_2$。这两个电还原反应均为多个基元反应构成的连续反应,其中所需能量最高的一步是整个反应的决速步骤。由图甲可知,对于三种催化剂上发生的$ N_2$电还原为$ NH_3$的反应,催化剂b对应决速步骤所需能量最小,反应最容易发生,其次为催化剂a,所需能量最大者为催化剂c。由图乙可知,在三种催化剂上发生$ H_2 O$电还原为$ H_2$的反应时,反应的决速步骤所需能量由小到大依次为cab,即在三种催化剂上$ H_2 O$电还原为$ H_2$,由易到难依次为cab。综合以上分析可知,三种催化剂中,催化剂b最有利于$ N_2$电还原为$ NH_3$反应的发生,其次为催化剂a,催化剂c的催化效果最差,即三种催化剂对$ N_2$电还原为$ NH_3$反应的催化活性由强到弱的顺序依次为bac。
(1)①+181 ②CD ③$\frac{0.21}{V}-\frac{2a+b}{2}$ $\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$
(2)0.75r
(3)①阴 ②$2 NH_3-6 e^-+6 OH^-= N_2+6 H_2 O$ ③bac
命题意图 本题考查化学反应原理,意在考查考生的理解分析能力,体现了“变化观念与平衡思想”“证据推理与模型认知”化学学科核心素养。
解题思路
(1)①$\Delta H_1=$反应物总键能-生成物总键能$=(945\ kJ· mol^{-1}+498\ kJ· mol^{-1})-2×631\ kJ· mol^{-1}=+181\ kJ· mol^{-1}$。
②缩小体积,所有物质浓度均增大,A项错误。升高温度,平衡向放热方向进行,反应ⅰ为吸热反应,反应ⅱ为放热反应,则升高温度,反应ⅰ正向移动,反应ⅱ逆向移动,$ NO$浓度增大,B项错误。移除$ NO_2$,反应ⅱ的平衡正向进行,$ NO$浓度降低,C项正确。降低$ N_2$浓度,平衡逆向进行,消耗$ NO$,$ NO$浓度降低,D项正确。
③方法一:守恒法计算
初始时,将1 mol空气置于容积为$V\ L$的恒容密闭容器中,$c( O_2)=\frac{0.21}{V}\ mol· L^{-1}$,$c( N_2)=\frac{0.78}{V}\ mol· L^{-1}$。平衡体系中,含有$ N_2\ b\ mol· L^{-1}$、$ NO\ a\ mol· L^{-1}$、$ NO_2$,由$ N$元素守恒可知,平衡时$c( N_2)=(\frac{0.78}{V}-\frac{a+b}{2})\ mol· L^{-1}$;同理,$ NO_2$分子中含有2个$ O$原子,$ NO$分子中含有1个$ O$原子,$ NO_2$和$ NO$中的$ O$原子全部来自$ O_2$,则反应中$c_{ 消耗}( O_2)=\frac{2a+b}{2}\ mol· L^{-1}$,根据氧原子守恒可知,平衡时,体系中$c( O_2)=(\frac{0.21}{V}-\frac{2a+b}{2})\ mol· L^{-1}$,$K_1=\frac{c^2( NO)}{c( N_2)· c( O_2)}=\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$。
方法二:“三段式”法计算
$ NO$在反应ⅰ中生成,反应ⅱ中消耗。$ NO$在反应ⅱ中的生成浓度=平衡浓度+反应ⅱ中的消耗浓度$=(a+b)\ mol· L^{-1}$。
反应ⅰ中$ O_2$的消耗浓度为$\frac{a+b}{2}\ mol· L^{-1}$,反应ⅱ中$ O_2$的消耗浓度为$\frac{a}{2}\ mol· L^{-1}$,平衡时体系中$ O_2$的浓度为$(\frac{0.21}{V}-\frac{2a+b}{2})\ mol· L^{-1}$。$ N_2$只参与了反应ⅰ,其在反应ⅰ中消耗的浓度为$\frac{a+b}{2}\ mol· L^{-1}$,平衡时体系中$ N_2$的浓度为$(\frac{0.78}{V}-\frac{a+b}{2})\ mol· L^{-1}$,$K_1=\frac{c^2( NO)}{c( N_2)· c( O_2)}=\frac{b^2}{(\frac{0.78}{V}-\frac{a+b}{2})(\frac{0.21}{V}-\frac{2a+b}{2})}$。
(2)实验1与实验2相比,$\frac{r}{2r}=\frac{k(0.10)^x(0.10)^y}{k(0.10)^x(0.20)^y}$,$y=1$,实验1与实验3相比,$\frac{r}{4r}=\frac{k(0.10)^x(0.10)^y}{k(0.20)^x(0.10)^y}$,$x=2$,实验1与实验4相比,$\frac{r}{v_4}=\frac{k(0.10)^2(0.10)}{k(0.05)^2(0.30)}$,$v_4=0.75r$。
(3)①$ N_2$生成$ NH_3$,化合价降低,得电子,发生还原反应,则$ N_2$在阴极反应产生$ NH_3$。
②氨燃料电池和氢燃料电池产生相同电量时,理论上消耗$ NH_3$和$ H_2$的质量比为17:3,可得出$ NH_3$和$ H_2$的物质的量之比为2:3,即2 mol $ NH_3$失去电子数与3 mol $ H_2$失去电子数相等。所以2 mol $ NH_3$共失去6 mol电子,氮元素的化合价从-3升高到0,产物应为$ N_2$。在碱性下发生的负极电极反应式为$2 NH_3-6 e^-+6 OH^-= N_2+6 H_2 O$。
③由题中信息可知,三种催化剂上都存在一对竞争反应:$ N_2$电还原为$ NH_3$和$ H_2 O$电还原为$ H_2$。这两个电还原反应均为多个基元反应构成的连续反应,其中所需能量最高的一步是整个反应的决速步骤。由图甲可知,对于三种催化剂上发生的$ N_2$电还原为$ NH_3$的反应,催化剂b对应决速步骤所需能量最小,反应最容易发生,其次为催化剂a,所需能量最大者为催化剂c。由图乙可知,在三种催化剂上发生$ H_2 O$电还原为$ H_2$的反应时,反应的决速步骤所需能量由小到大依次为cab,即在三种催化剂上$ H_2 O$电还原为$ H_2$,由易到难依次为cab。综合以上分析可知,三种催化剂中,催化剂b最有利于$ N_2$电还原为$ NH_3$反应的发生,其次为催化剂a,催化剂c的催化效果最差,即三种催化剂对$ N_2$电还原为$ NH_3$反应的催化活性由强到弱的顺序依次为bac。
查看更多完整答案,请扫码查看


