2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第79页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
11. [2025·重庆卷,7T,3 分]三种氮氧化物的结构如下所示:
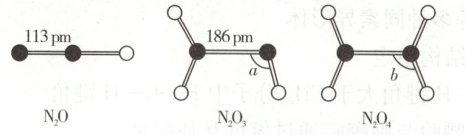
下列说法正确的是(
A.氮氮键键能:N₂O > N₂O₃
B.熔点:N₂O₃ > N₂O₄
C.分子极性:N₂O₄ > N₂O
D.N—N—O 键角:a > b

下列说法正确的是(
A
)A.氮氮键键能:N₂O > N₂O₃
B.熔点:N₂O₃ > N₂O₄
C.分子极性:N₂O₄ > N₂O
D.N—N—O 键角:a > b
答案:
11.参考答案A
命题意图本题以三种氮氧化物为载体,考查键能、熔点、极性和键角的影响因素,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路键长越短,键能越大,由图中数据可知,氮氮键的键长${N_{2}O < N_{2}O_{3}}$,则氮氮键的键能${N_{2}O > N_{2}O_{3}}$,A项正确。${N_{2}O_{3}}$和${N_{2}O_{4}}$均为由分子构成的物质,分子间作用力主要为范德华力,相对分子质量越大,范德华力越大,故熔点${N_{2}O_{3} < N_{2}O_{4}}$,B项错误。${N_{2}O_{4}}$为对称的平面结构,正电中心与负电中心基本重合,极性较弱,而${N_{2}O}$结构不对称,正电中心与负电中心不能重合,属于典型的极性分子,故分子极性${N_{2}O_{4} < N_{2}O}$,C项错误。${N_{2}O_{3}}$结构中右侧N原子的孤电子对数为1,成键电子对数为2,价层电子对为3,中心N原子为${sp^{2}}$杂化,受孤电子对影响,N—N—O键角小于120°。而${N_{2}O_{4}}$的中心N原子的孤电子对数为0,成键电子对数为3,价层电子对数为3,中心N原子为${sp^{2}}$杂化,无孤电子对的影响,N—N—O的键角为120°,故N—N—O的键角${\alpha < b}$,D项错误。
学习拓展
${N_{2}O_{3}}$和${N_{2}O_{4}}$中N原子的杂化方式
(1)${N_{2}O_{3}}$的结构为 ,左侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个氧原子及右N各成一个σ键。${p_{z}}$轨道有两个电子,左边两个氧原子各有一个${p_{z}}$电子。所以${N_{2}O_{3}}$分子中左侧的N和两个氧在z方向形成${\Pi^{4}_{3}}$。右侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道与右边O原子及左侧N原子各成一个σ键,同时有一个孤电子对参与杂化,${p_{z}}$轨道的一个电子与右侧氧原子的${p_{z}}$轨道轨道的电子成π键。
,左侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个氧原子及右N各成一个σ键。${p_{z}}$轨道有两个电子,左边两个氧原子各有一个${p_{z}}$电子。所以${N_{2}O_{3}}$分子中左侧的N和两个氧在z方向形成${\Pi^{4}_{3}}$。右侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道与右边O原子及左侧N原子各成一个σ键,同时有一个孤电子对参与杂化,${p_{z}}$轨道的一个电子与右侧氧原子的${p_{z}}$轨道轨道的电子成π键。
(2)${N_{2}O_{4}}$的结构为 ,两个N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个O原子及右N各成一个σ键。每个N原子的${p_{z}}$轨道有两个电子,与之相连的两个端基O原子各有1个${p_{z}}$电子,分别形成两个${\Pi^{4}_{3}}$。
,两个N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个O原子及右N各成一个σ键。每个N原子的${p_{z}}$轨道有两个电子,与之相连的两个端基O原子各有1个${p_{z}}$电子,分别形成两个${\Pi^{4}_{3}}$。
11.参考答案A
命题意图本题以三种氮氧化物为载体,考查键能、熔点、极性和键角的影响因素,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路键长越短,键能越大,由图中数据可知,氮氮键的键长${N_{2}O < N_{2}O_{3}}$,则氮氮键的键能${N_{2}O > N_{2}O_{3}}$,A项正确。${N_{2}O_{3}}$和${N_{2}O_{4}}$均为由分子构成的物质,分子间作用力主要为范德华力,相对分子质量越大,范德华力越大,故熔点${N_{2}O_{3} < N_{2}O_{4}}$,B项错误。${N_{2}O_{4}}$为对称的平面结构,正电中心与负电中心基本重合,极性较弱,而${N_{2}O}$结构不对称,正电中心与负电中心不能重合,属于典型的极性分子,故分子极性${N_{2}O_{4} < N_{2}O}$,C项错误。${N_{2}O_{3}}$结构中右侧N原子的孤电子对数为1,成键电子对数为2,价层电子对为3,中心N原子为${sp^{2}}$杂化,受孤电子对影响,N—N—O键角小于120°。而${N_{2}O_{4}}$的中心N原子的孤电子对数为0,成键电子对数为3,价层电子对数为3,中心N原子为${sp^{2}}$杂化,无孤电子对的影响,N—N—O的键角为120°,故N—N—O的键角${\alpha < b}$,D项错误。
学习拓展
${N_{2}O_{3}}$和${N_{2}O_{4}}$中N原子的杂化方式
(1)${N_{2}O_{3}}$的结构为
 ,左侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个氧原子及右N各成一个σ键。${p_{z}}$轨道有两个电子,左边两个氧原子各有一个${p_{z}}$电子。所以${N_{2}O_{3}}$分子中左侧的N和两个氧在z方向形成${\Pi^{4}_{3}}$。右侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道与右边O原子及左侧N原子各成一个σ键,同时有一个孤电子对参与杂化,${p_{z}}$轨道的一个电子与右侧氧原子的${p_{z}}$轨道轨道的电子成π键。
,左侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个氧原子及右N各成一个σ键。${p_{z}}$轨道有两个电子,左边两个氧原子各有一个${p_{z}}$电子。所以${N_{2}O_{3}}$分子中左侧的N和两个氧在z方向形成${\Pi^{4}_{3}}$。右侧N原子为${sp^{2}}$杂化,有单电子的杂化轨道与右边O原子及左侧N原子各成一个σ键,同时有一个孤电子对参与杂化,${p_{z}}$轨道的一个电子与右侧氧原子的${p_{z}}$轨道轨道的电子成π键。(2)${N_{2}O_{4}}$的结构为
 ,两个N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个O原子及右N各成一个σ键。每个N原子的${p_{z}}$轨道有两个电子,与之相连的两个端基O原子各有1个${p_{z}}$电子,分别形成两个${\Pi^{4}_{3}}$。
,两个N原子为${sp^{2}}$杂化,有单电子的杂化轨道和左边两个O原子及右N各成一个σ键。每个N原子的${p_{z}}$轨道有两个电子,与之相连的两个端基O原子各有1个${p_{z}}$电子,分别形成两个${\Pi^{4}_{3}}$。 12. [2024·甘肃卷,13T,3 分]温室气体 N₂O 在催化剂作用下可分解为 O₂ 和 N₂,也可作为氧化剂氧化苯制苯酚。下列说法错误的是(
A.原子半径:O < N < C
B.第一电离能:C < N < O
C.在水中的溶解度:苯 < 苯酚
D.苯和苯酚中 C 的杂化方式相同
B
)A.原子半径:O < N < C
B.第一电离能:C < N < O
C.在水中的溶解度:苯 < 苯酚
D.苯和苯酚中 C 的杂化方式相同
答案:
12.参考答案B
命题意图本题考查物质结构与性质,涉及元素周期律、分子极性、杂化方式等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路O、N、C元素均属于第二周期,原子序数${C < N < O}$,同一周期元素的原子半径从左到右逐渐减小,即原子半径${O < N < C}$,A项正确。同一周期元素的第一电离能从左到右呈增大趋势,但N原子的2p轨道为半充满的稳定状态,其第一电离能大于O,则第一电离能${C < O < N}$,B项错误。水是极性分子,苯是非极性分子,根据相似相溶原理可知,苯难溶于水,苯酚能与水分子间形成氢键,使苯酚的溶解度增大,即在水中的溶解度苯<苯酚,C项正确。苯、苯酚中C原子杂化方式均为${sp^{2}}$,D项正确。
命题意图本题考查物质结构与性质,涉及元素周期律、分子极性、杂化方式等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路O、N、C元素均属于第二周期,原子序数${C < N < O}$,同一周期元素的原子半径从左到右逐渐减小,即原子半径${O < N < C}$,A项正确。同一周期元素的第一电离能从左到右呈增大趋势,但N原子的2p轨道为半充满的稳定状态,其第一电离能大于O,则第一电离能${C < O < N}$,B项错误。水是极性分子,苯是非极性分子,根据相似相溶原理可知,苯难溶于水,苯酚能与水分子间形成氢键,使苯酚的溶解度增大,即在水中的溶解度苯<苯酚,C项正确。苯、苯酚中C原子杂化方式均为${sp^{2}}$,D项正确。
13. [2024·甘肃卷,14T,3 分]下列说法错误的是(
A.相同条件下 N₂ 比 O₂ 稳定
B.N₂O 与 NO₂⁺ 的空间构型相同
C.N₂O 中 N—O 键比 N—N 键更易断裂
D.N₂O 中 σ 键和大 π 键的数目不相等
D
)A.相同条件下 N₂ 比 O₂ 稳定
B.N₂O 与 NO₂⁺ 的空间构型相同
C.N₂O 中 N—O 键比 N—N 键更易断裂
D.N₂O 中 σ 键和大 π 键的数目不相等
答案:
13.参考答案D
命题意图本题考查分子的结构与性质,意在考查考生的分析应用能力,体现了“证据推理与模型认知”化学学科核心素养。
解题思路${N_{2}}$分子中含有${N\equiv N}$,${O_{2}}$分子中含有${O=O}$,${N\equiv N}$键能更大,不容易断裂,则稳定性${N_{2} > O_{2}}$,A项正确。${N_{2}O}$与${NO^{+}_{2}}$均为${CO_{2}}$的等电子体,具有相同的空间构型,均为直线形,B项正确。根据题目信息,${N_{2}O}$在催化剂作用下可分解为${O_{2}}$和${N_{2}}$,说明此过程中N—O键断裂,N—O键比N—N键更易断裂,C项正确。${N_{2}O}$中心氮原子采取sp杂化,形成在同一条直线上的两个sp杂化轨道,分别与两侧的O、N形成O—N和N—N两个σ键,另两个与其垂直的未杂化的2p轨道与两侧原子的同位置2p轨道互相“肩并肩”重叠,形成两个互相垂直的3中心4电子的大π键 ,则${N_{2}O}$中含有2个σ键,且含有2个大π键(${\Pi^{4}_{3}}$),所以${N_{2}O}$中σ键和大π键的数目相等,D项错误。
,则${N_{2}O}$中含有2个σ键,且含有2个大π键(${\Pi^{4}_{3}}$),所以${N_{2}O}$中σ键和大π键的数目相等,D项错误。
13.参考答案D
命题意图本题考查分子的结构与性质,意在考查考生的分析应用能力,体现了“证据推理与模型认知”化学学科核心素养。
解题思路${N_{2}}$分子中含有${N\equiv N}$,${O_{2}}$分子中含有${O=O}$,${N\equiv N}$键能更大,不容易断裂,则稳定性${N_{2} > O_{2}}$,A项正确。${N_{2}O}$与${NO^{+}_{2}}$均为${CO_{2}}$的等电子体,具有相同的空间构型,均为直线形,B项正确。根据题目信息,${N_{2}O}$在催化剂作用下可分解为${O_{2}}$和${N_{2}}$,说明此过程中N—O键断裂,N—O键比N—N键更易断裂,C项正确。${N_{2}O}$中心氮原子采取sp杂化,形成在同一条直线上的两个sp杂化轨道,分别与两侧的O、N形成O—N和N—N两个σ键,另两个与其垂直的未杂化的2p轨道与两侧原子的同位置2p轨道互相“肩并肩”重叠,形成两个互相垂直的3中心4电子的大π键
 ,则${N_{2}O}$中含有2个σ键,且含有2个大π键(${\Pi^{4}_{3}}$),所以${N_{2}O}$中σ键和大π键的数目相等,D项错误。
,则${N_{2}O}$中含有2个σ键,且含有2个大π键(${\Pi^{4}_{3}}$),所以${N_{2}O}$中σ键和大π键的数目相等,D项错误。 14. [2024·广西卷,5T,3 分]白磷(P₄)是不溶于水的固体,在空气中易自燃。下列有关白磷的说法错误的是(
A.分子中每个 P 原子的孤电子对数均为 1
B.常保存于水中,说明白磷密度大于 1 g·cm⁻³
C.难溶于水,是因为水是极性分子,P₄ 是非极性分子
D.熔点低,是因为 P₄ 分子内的 P—P 键弱
D
)A.分子中每个 P 原子的孤电子对数均为 1
B.常保存于水中,说明白磷密度大于 1 g·cm⁻³
C.难溶于水,是因为水是极性分子,P₄ 是非极性分子
D.熔点低,是因为 P₄ 分子内的 P—P 键弱
答案:
14.参考答案D
命题意图本题以白磷的性质为载体,考查物质的结构与性质,涉及孤电子对数、化学键、分子极性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路白磷的分子式为${P_{4}}$,空间结构为正四面体形,每个P原子形成3个P—P键,而每个P原子有5个价电子,所以每个P原子均还剩一个孤电子对,A项正确。白磷在空气中容易自燃,常保存于水中隔绝空气,说明其密度大于水,B项正确。白磷为非极性分子,水为极性分子,根据“相似相溶”原理,白磷难溶于水,C项正确。白磷为分子晶体,分子间作用力较弱,故其熔点低,与分子内的P—P键强弱无关,D项错误。
命题意图本题以白磷的性质为载体,考查物质的结构与性质,涉及孤电子对数、化学键、分子极性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路白磷的分子式为${P_{4}}$,空间结构为正四面体形,每个P原子形成3个P—P键,而每个P原子有5个价电子,所以每个P原子均还剩一个孤电子对,A项正确。白磷在空气中容易自燃,常保存于水中隔绝空气,说明其密度大于水,B项正确。白磷为非极性分子,水为极性分子,根据“相似相溶”原理,白磷难溶于水,C项正确。白磷为分子晶体,分子间作用力较弱,故其熔点低,与分子内的P—P键强弱无关,D项错误。
15. [2024·重庆卷,3T,3 分]下列各分子既含有 sp² 杂化的原子又能与 H₂O 形成氢键的是(
A.CH₃CH₃
B.CH₂ = CHBr
C.CH₃COOH
D.CH₃CH₂NH₂
C
)A.CH₃CH₃
B.CH₂ = CHBr
C.CH₃COOH
D.CH₃CH₂NH₂
答案:
15.参考答案C
命题意图本题考查原子杂化方式和氢键,意在考查考生对相关知识的理解应用能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路${CH_{3}CH_{3}}$中两个碳原子的价层电子对数均为4,均采取${sp^{3}}$杂化,且和${H_{2}O}$不能形成分子间氢键,A项不符合题意。${CH_{2}=CHBr}$中两个碳原子的价层电子对数均为3,均采用${sp^{2}}$杂化,但不能和${H_{2}O}$形成分子间氢键,B项不符合题意。${CH_{3}COOH}$的羧基中的碳原子的价层电子对数为3,采取${sp^{2}}$杂化,且能和${H_{2}O}$形成分子间氢键,C项符合题意。${CH_{3}CH_{2}NH_{2}}$中碳、氮原子的价层电子对数均为4,均采用${sp^{3}}$杂化,能和${H_{2}O}$形成分子间氢键,D项不符合题意。
命题意图本题考查原子杂化方式和氢键,意在考查考生对相关知识的理解应用能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路${CH_{3}CH_{3}}$中两个碳原子的价层电子对数均为4,均采取${sp^{3}}$杂化,且和${H_{2}O}$不能形成分子间氢键,A项不符合题意。${CH_{2}=CHBr}$中两个碳原子的价层电子对数均为3,均采用${sp^{2}}$杂化,但不能和${H_{2}O}$形成分子间氢键,B项不符合题意。${CH_{3}COOH}$的羧基中的碳原子的价层电子对数为3,采取${sp^{2}}$杂化,且能和${H_{2}O}$形成分子间氢键,C项符合题意。${CH_{3}CH_{2}NH_{2}}$中碳、氮原子的价层电子对数均为4,均采用${sp^{3}}$杂化,能和${H_{2}O}$形成分子间氢键,D项不符合题意。
16. [2024·江西卷,2T,3 分]科学家发现宇宙中存在 100 多种星际分子。下列关于星际分子说法正确的是(
A.分子的极性:SiH₄ > NH₃
B.键的极性:H—Cl > H—H
C.键角:H₂O > CH₄
D.分子中三键的键长:HC≡N > HC≡CH
B
)A.分子的极性:SiH₄ > NH₃
B.键的极性:H—Cl > H—H
C.键角:H₂O > CH₄
D.分子中三键的键长:HC≡N > HC≡CH
答案:
16.参考答案B
命题意图本题以星际分子为素材,涉及极性、键角、键长等知识,意在考查考生对基础知识的掌握情况,体现了“证据推理与模型认知”化学学科核心素养。
解题思路${SiH_{4}}$为正四面体形结构,正电中心与负电中心重合,为非极性分子,${NH_{3}}$为三角锥形结构,含有1个孤电子对,为极性分子,则分子极性${SiH_{4} < NH_{3}}$,A项错误。${H - H}$为非极性键,${H - Cl}$为极性键,则键的极性${H - Cl > H - H}$,B项正确。水分子为V形结构,含2个孤电子对,甲烷为正四面体结构,不含孤电子对,二者中心原子的杂化方式均为${sp^{3}}$,则键角${H_{2}O < CH_{4}}$,C项错误。原子半径${C > N}$,分子中三键的键长${HC\equiv N < HC\equiv CH}$,D项错误。
命题意图本题以星际分子为素材,涉及极性、键角、键长等知识,意在考查考生对基础知识的掌握情况,体现了“证据推理与模型认知”化学学科核心素养。
解题思路${SiH_{4}}$为正四面体形结构,正电中心与负电中心重合,为非极性分子,${NH_{3}}$为三角锥形结构,含有1个孤电子对,为极性分子,则分子极性${SiH_{4} < NH_{3}}$,A项错误。${H - H}$为非极性键,${H - Cl}$为极性键,则键的极性${H - Cl > H - H}$,B项正确。水分子为V形结构,含2个孤电子对,甲烷为正四面体结构,不含孤电子对,二者中心原子的杂化方式均为${sp^{3}}$,则键角${H_{2}O < CH_{4}}$,C项错误。原子半径${C > N}$,分子中三键的键长${HC\equiv N < HC\equiv CH}$,D项错误。
17. [2024·湖北卷,5T,3 分]基本概念和理论是化学思维的基石。下列叙述错误的是(
A.VSEPR 理论认为 VSEPR 模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp³ 杂化轨道由 1 个 s 轨道和 3 个 p 轨道混杂而成
A
)A.VSEPR 理论认为 VSEPR 模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.sp³ 杂化轨道由 1 个 s 轨道和 3 个 p 轨道混杂而成
答案:
17.参考答案A
命题意图本题以化学基本概念和理论为素材,涉及VSEPR理论、元素周期律、泡利原理、杂化轨道等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路VSEPR模型是价层电子对的空间结构模型,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对,当中心原子无孤电子对时,二者相同,当中心原子有孤电子对时,二者不同,A项错误。元素的性质随着原子序数的递增而呈周期性变化,这一规律叫元素周期律,元素性质的周期性的变化是元素原子的核外电子排布周期性变化的必然结果,B项正确。在一个原子轨道内,最多只能容纳2个电子,它们的自旋方向相反,这个原理被称为泡利原理,C项正确。1个s轨道和3个p轨道混杂形成4个能量相同、方向不同的轨道,称为${sp^{3}}$杂化轨道,D项正确。
命题意图本题以化学基本概念和理论为素材,涉及VSEPR理论、元素周期律、泡利原理、杂化轨道等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路VSEPR模型是价层电子对的空间结构模型,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对,当中心原子无孤电子对时,二者相同,当中心原子有孤电子对时,二者不同,A项错误。元素的性质随着原子序数的递增而呈周期性变化,这一规律叫元素周期律,元素性质的周期性的变化是元素原子的核外电子排布周期性变化的必然结果,B项正确。在一个原子轨道内,最多只能容纳2个电子,它们的自旋方向相反,这个原理被称为泡利原理,C项正确。1个s轨道和3个p轨道混杂形成4个能量相同、方向不同的轨道,称为${sp^{3}}$杂化轨道,D项正确。
18. [2024·安徽卷,7T,3 分]下列有关物质结构或性质的比较中,正确的是(
A.键角:NH₃ > NO₃⁻
B.熔点:NH₂OH > [NH₃OH]Cl
C.25℃同浓度水溶液的 pH:[NH₃OH]Cl > NH₄Cl
D.羟胺分子间氢键的强弱:O—H…O > N—H…N
D
)A.键角:NH₃ > NO₃⁻
B.熔点:NH₂OH > [NH₃OH]Cl
C.25℃同浓度水溶液的 pH:[NH₃OH]Cl > NH₄Cl
D.羟胺分子间氢键的强弱:O—H…O > N—H…N
答案:
18.参考答案D
命题意图本题考查物质的结构与性质,涉及键角大小、熔点高低、水溶液pH大小、氢键强弱的判断,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路${NH_{3}}$中N原子的价层电子对数为$3 + \frac{1}{2} × (5 - 3 × 1) = 4$,N采取${sp^{3}}$杂化,N上有1个孤电子对,${NH_{3}}$的空间构型为三角锥形;${NO^{-}_{3}}$中N的价层电子对数为$3 + \frac{1}{2} × (5 + 1 - 3 × 2) = 3$,N采取${sp^{2}}$杂化,N上没有孤电子对,${NO^{-}_{3}}$的空间构型为平面三角形,故键角${NH_{3} < NO^{-}_{3}}$,A项错误。${NH_{2}OH}$为分子晶体,${[NH_{3}OH]Cl}$为离子晶体,熔点${NH_{2}OH < [NH_{3}OH]Cl}$,B项错误。由题目信息可知,25℃时,${\mathit{K}_{\mathrm{b}}(NH_{3}· H_{2}O) > \mathit{K}_{\mathrm{b}}(NH_{2}OH)}$,${NH_{2}OH}$的碱性比${NH_{3}· H_{2}O}$弱,同浓度的${[NH_{3}OH]Cl}$、${NH_{4}Cl}$溶液中,${[NH_{3}OH]^{+}}$的水解程度大于${NH^{+}_{4}}$,故同浓度水溶液的pH:${[NH_{3}OH]Cl < NH_{4}Cl}$。C项错误。O的电负性大于N且O的原子半径小于N,${O - H}$键的极性大于${N - H}$键,故羟胺分子间氢键${O - H·s O}$强于${N - H·s N}$,D项正确。
命题意图本题考查物质的结构与性质,涉及键角大小、熔点高低、水溶液pH大小、氢键强弱的判断,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路${NH_{3}}$中N原子的价层电子对数为$3 + \frac{1}{2} × (5 - 3 × 1) = 4$,N采取${sp^{3}}$杂化,N上有1个孤电子对,${NH_{3}}$的空间构型为三角锥形;${NO^{-}_{3}}$中N的价层电子对数为$3 + \frac{1}{2} × (5 + 1 - 3 × 2) = 3$,N采取${sp^{2}}$杂化,N上没有孤电子对,${NO^{-}_{3}}$的空间构型为平面三角形,故键角${NH_{3} < NO^{-}_{3}}$,A项错误。${NH_{2}OH}$为分子晶体,${[NH_{3}OH]Cl}$为离子晶体,熔点${NH_{2}OH < [NH_{3}OH]Cl}$,B项错误。由题目信息可知,25℃时,${\mathit{K}_{\mathrm{b}}(NH_{3}· H_{2}O) > \mathit{K}_{\mathrm{b}}(NH_{2}OH)}$,${NH_{2}OH}$的碱性比${NH_{3}· H_{2}O}$弱,同浓度的${[NH_{3}OH]Cl}$、${NH_{4}Cl}$溶液中,${[NH_{3}OH]^{+}}$的水解程度大于${NH^{+}_{4}}$,故同浓度水溶液的pH:${[NH_{3}OH]Cl < NH_{4}Cl}$。C项错误。O的电负性大于N且O的原子半径小于N,${O - H}$键的极性大于${N - H}$键,故羟胺分子间氢键${O - H·s O}$强于${N - H·s N}$,D项正确。
查看更多完整答案,请扫码查看


