2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
3. [2025·安徽卷,16T,14分]侯氏制碱法以$NaCl$、$CO_{2}$和$NH_{3}$为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以$NaCl$和$NH_{4}HCO_{3}$为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的$NH_{4}HCO_{3}$加入饱和食盐水中,搅拌,使$NH_{4}HCO_{3}$溶解,静置,析出$NaHCO_{3}$晶体;
③将$NaHCO_{3}$晶体减压过滤、煅烧,得到$Na_{2}CO_{3}$固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有
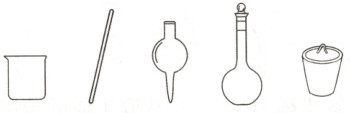
(2)步骤②中$NH_{4}HCO_{3}$需研细后加入,目的是
(3)在实验室使用$NH_{4}HCO_{3}$代替$CO_{2}$和$NH_{3}$制备纯碱,优点是
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的$pH$随滴加盐酸体积变化的曲线如右图所示。
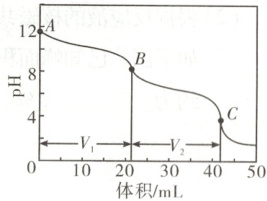
ⅰ. 到达第一个滴定终点$B$时消耗盐酸$V_{1}\ mL$,到达第二个滴定终点$C$时又消耗盐酸$V_{2}\ mL$。$V_{1} = V_{2}$,所得产品的成分为
a.$Na_{2}CO_{3}$
b.$NaHCO_{3}$
d.$Na_{2}CO_{3}$和$NaOH$
c.$Na_{2}CO_{3}$和$NaHCO_{3}$
ⅱ. 到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的$V'_{1}$
(5)已知常温下$Na_{2}CO_{3}$和$NaHCO_{3}$的溶解度分别为$30.7\ g$和$10.3\ g$。向饱和$Na_{2}CO_{3}$溶液中持续通入$CO_{2}$气体会产生$NaHCO_{3}$晶体。实验小组进行相应探究:

ⅰ. 实验a无明显现象的原因是
ⅱ. 析出的白色晶体可能同时含有$NaHCO_{3}$和$Na_{2}CO_{3}· 10H_{2}O$。称取$0.42\ g$晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水$CaCl_{2}$和$NaOH$溶液,$NaOH$溶液增重$0.088\ g$,则白色晶体中$NaHCO_{3}$的质量分数为
①配制饱和食盐水;
②在水浴加热下,将一定量研细的$NH_{4}HCO_{3}$加入饱和食盐水中,搅拌,使$NH_{4}HCO_{3}$溶解,静置,析出$NaHCO_{3}$晶体;
③将$NaHCO_{3}$晶体减压过滤、煅烧,得到$Na_{2}CO_{3}$固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有
烧杯、玻璃棒
(填名称)。
(2)步骤②中$NH_{4}HCO_{3}$需研细后加入,目的是
增大${NH_{4}HCO_{3}}$与饱和食盐水的接触面积,加快溶解和反应速率
。(3)在实验室使用$NH_{4}HCO_{3}$代替$CO_{2}$和$NH_{3}$制备纯碱,优点是
简化操作步骤,原料易得且利用率较高,无氨气参与反应,更加环保
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的$pH$随滴加盐酸体积变化的曲线如右图所示。

ⅰ. 到达第一个滴定终点$B$时消耗盐酸$V_{1}\ mL$,到达第二个滴定终点$C$时又消耗盐酸$V_{2}\ mL$。$V_{1} = V_{2}$,所得产品的成分为
a
(填标号)。a.$Na_{2}CO_{3}$
b.$NaHCO_{3}$
d.$Na_{2}CO_{3}$和$NaOH$
c.$Na_{2}CO_{3}$和$NaHCO_{3}$
ⅱ. 到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的$V'_{1}$
$>$
$V_{1}$(填“$>$”“$<$”或“$=$”)。(5)已知常温下$Na_{2}CO_{3}$和$NaHCO_{3}$的溶解度分别为$30.7\ g$和$10.3\ g$。向饱和$Na_{2}CO_{3}$溶液中持续通入$CO_{2}$气体会产生$NaHCO_{3}$晶体。实验小组进行相应探究:

ⅰ. 实验a无明显现象的原因是
开放体系导致${CO_{2}}$逸出,生成的${NaHCO_{3}}$的量较少,${NaHCO_{3}}$在该溶液中未达到过饱和状态
。ⅱ. 析出的白色晶体可能同时含有$NaHCO_{3}$和$Na_{2}CO_{3}· 10H_{2}O$。称取$0.42\ g$晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水$CaCl_{2}$和$NaOH$溶液,$NaOH$溶液增重$0.088\ g$,则白色晶体中$NaHCO_{3}$的质量分数为
$80\%$
。
答案:
3. 参考答案
(1)烧杯、玻璃棒
(2)增大${NH_{4}HCO_{3}}$与饱和食盐水的接触面积,加快溶解和反应速率
(3)简化操作步骤,原料易得且利用率较高,无氨气参与反应,更加环保
(4)i.a ⅱ.$>$
(5)i.开放体系导致${CO_{2}}$逸出,生成的${NaHCO_{3}}$的量较少,${NaHCO_{3}}$在该溶液中未达到过饱和状态 ⅱ.$80\%$
命题意图本题通过纯碱制备实验优化,考查实验装置的选择、操作目的、滴定分析及晶体析出条件探究,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(1)配制饱和食盐水的操作为向烧杯中放入一定量的食盐,然后向其中加入蒸馏水并用玻璃棒搅拌加速溶解,不断加入食盐,直至杯底有少量白色晶体不再溶解即得饱和食盐水,因此给出的仪器中需要使用的有烧杯和玻璃棒。
(4)i.根据图中的曲线变化可知,到达第一个滴定终点$B$时,发生的反应为${Na_{2}CO_{3} + HCl\xlongequal{}NaCl + NaHCO_{3}}$,消耗盐酸$V_{1}\ {mL}$;到达第二个滴定终点$C$时,发生的反应为${NaHCO_{3} + HCl\xlongequal{}NaCl + CO_{2}\uparrow + H_{2}O}$,又消耗盐酸$V_{2}\ {mL}$。$V_{1}=V_{2}$,说明产品中不含${NaHCO_{3}}$和${NaOH}$,只含${Na_{2}CO_{3}}$,a项正确。ii.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓,导致一部分${Na_{2}CO_{3}}$与盐酸反应生成${CO_{2}}$,说明相对于第一滴定终点,滴加盐酸较多,从而使得该同学所记录的$V_{1}'>V_{1}$,$V_{2}'<V_{2}$。
(5)i.${NaHCO_{3}}$受热分解生成的气体中有水蒸气和${CO_{2}}$,而${Na_{2}CO_{3}· 10H_{2}O}$分解产生的气体中只有水蒸气。无水${CaCl_{2}}$可以吸收分解产生的水蒸气,${NaOH}$溶液可以吸收分解产生的${CO_{2}}$。${NaOH}$溶液增重$0.088\ {g}$,则分解产生的${CO_{2}}$的质量为$0.088\ {g}$,其物质的量为$\dfrac{0.088\ {g}}{44\ {g· mol^{-1}}}=0.002\ {mol}$,根据反应${2NaHCO_{3}\xlongequal{\triangle }Na_{2}CO_{3} + H_{2}O\uparrow + CO_{2}\uparrow}$,${NaHCO_{3}}$的物质的量为$0.004\ {mol}$,则白色晶体中${NaHCO_{3}}$的质量为$0.004\ {mol}×84\ {g· mol^{-1}}=0.336\ {g}$,其质量分数为$\dfrac{0.336\ {g}}{0.42\ {g}}×100\%=80\%$
(1)烧杯、玻璃棒
(2)增大${NH_{4}HCO_{3}}$与饱和食盐水的接触面积,加快溶解和反应速率
(3)简化操作步骤,原料易得且利用率较高,无氨气参与反应,更加环保
(4)i.a ⅱ.$>$
(5)i.开放体系导致${CO_{2}}$逸出,生成的${NaHCO_{3}}$的量较少,${NaHCO_{3}}$在该溶液中未达到过饱和状态 ⅱ.$80\%$
命题意图本题通过纯碱制备实验优化,考查实验装置的选择、操作目的、滴定分析及晶体析出条件探究,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(1)配制饱和食盐水的操作为向烧杯中放入一定量的食盐,然后向其中加入蒸馏水并用玻璃棒搅拌加速溶解,不断加入食盐,直至杯底有少量白色晶体不再溶解即得饱和食盐水,因此给出的仪器中需要使用的有烧杯和玻璃棒。
(4)i.根据图中的曲线变化可知,到达第一个滴定终点$B$时,发生的反应为${Na_{2}CO_{3} + HCl\xlongequal{}NaCl + NaHCO_{3}}$,消耗盐酸$V_{1}\ {mL}$;到达第二个滴定终点$C$时,发生的反应为${NaHCO_{3} + HCl\xlongequal{}NaCl + CO_{2}\uparrow + H_{2}O}$,又消耗盐酸$V_{2}\ {mL}$。$V_{1}=V_{2}$,说明产品中不含${NaHCO_{3}}$和${NaOH}$,只含${Na_{2}CO_{3}}$,a项正确。ii.到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓,导致一部分${Na_{2}CO_{3}}$与盐酸反应生成${CO_{2}}$,说明相对于第一滴定终点,滴加盐酸较多,从而使得该同学所记录的$V_{1}'>V_{1}$,$V_{2}'<V_{2}$。
(5)i.${NaHCO_{3}}$受热分解生成的气体中有水蒸气和${CO_{2}}$,而${Na_{2}CO_{3}· 10H_{2}O}$分解产生的气体中只有水蒸气。无水${CaCl_{2}}$可以吸收分解产生的水蒸气,${NaOH}$溶液可以吸收分解产生的${CO_{2}}$。${NaOH}$溶液增重$0.088\ {g}$,则分解产生的${CO_{2}}$的质量为$0.088\ {g}$,其物质的量为$\dfrac{0.088\ {g}}{44\ {g· mol^{-1}}}=0.002\ {mol}$,根据反应${2NaHCO_{3}\xlongequal{\triangle }Na_{2}CO_{3} + H_{2}O\uparrow + CO_{2}\uparrow}$,${NaHCO_{3}}$的物质的量为$0.004\ {mol}$,则白色晶体中${NaHCO_{3}}$的质量为$0.004\ {mol}×84\ {g· mol^{-1}}=0.336\ {g}$,其质量分数为$\dfrac{0.336\ {g}}{0.42\ {g}}×100\%=80\%$
查看更多完整答案,请扫码查看


