2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
15. (15分)氢碘酸常用于合成碘化物。某化学兴趣小组用如图装置(夹持装置等略)制备氢碘酸。
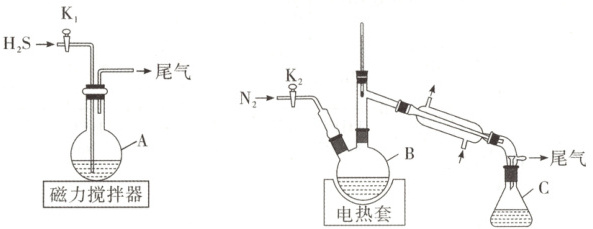
步骤如下:
ⅰ. 在$A$中加入$150\ mL\ H_{2}O$和$127\ g\ I_{2}$,快速搅拌,打开$K_{1}$通入$H_{2}S$,反应完成后,关闭$K_{1}$,静置、过滤得滤液;
ⅱ. 将滤液转移至$B$中,打开$K_{2}$通入$N_{2}$,接通冷凝水,加热保持微沸,直至$H_{2}S$除尽;
ⅲ. 继续加热蒸馏,$C$中收集沸点为$125\sim127^{\circ}C$间的馏分,得到$117\ mL$氢碘酸(密度为$1.7\ g· mL^{-1}$,$HI$质量分数为$57\%$)。
回答下列问题:
(1)仪器$A$的名称:
(2)步骤ⅰ中快速搅拌的目的:
a. 便于产物分离
b. 防止暴沸
c. 防止固体产物包覆碘
(3)步骤ⅰ中随着反应的进行,促进碘溶解的原因
(4)步骤ⅱ中的尾气常用
(5)步骤ⅱ实验开始时的操作顺序:先通入$N_{2}$,再加热;步骤ⅲ实验结束时相对应的操作顺序:
(6)列出本实验产率的计算表达式:
(7)氢碘酸见光易分解,易被空气氧化,应保存在

步骤如下:
ⅰ. 在$A$中加入$150\ mL\ H_{2}O$和$127\ g\ I_{2}$,快速搅拌,打开$K_{1}$通入$H_{2}S$,反应完成后,关闭$K_{1}$,静置、过滤得滤液;
ⅱ. 将滤液转移至$B$中,打开$K_{2}$通入$N_{2}$,接通冷凝水,加热保持微沸,直至$H_{2}S$除尽;
ⅲ. 继续加热蒸馏,$C$中收集沸点为$125\sim127^{\circ}C$间的馏分,得到$117\ mL$氢碘酸(密度为$1.7\ g· mL^{-1}$,$HI$质量分数为$57\%$)。
回答下列问题:
(1)仪器$A$的名称:
圆底烧瓶
,通入$H_{2}S$发生反应的化学方程式:H₂S + I₂ = 2HI + S
。(2)步骤ⅰ中快速搅拌的目的:
c
(填序号)。a. 便于产物分离
b. 防止暴沸
c. 防止固体产物包覆碘
(3)步骤ⅰ中随着反应的进行,促进碘溶解的原因
I₂ + I⁻ ⇌ I₃⁻
(用离子方程式表示)。(4)步骤ⅱ中的尾气常用
NaOH
(填化学式)溶液吸收。(5)步骤ⅱ实验开始时的操作顺序:先通入$N_{2}$,再加热;步骤ⅲ实验结束时相对应的操作顺序:
先停止加热,再停止通入N₂
。(6)列出本实验产率的计算表达式:
(117×1.7×57%)/128 × 100%
。(7)氢碘酸见光易分解,易被空气氧化,应保存在
具玻璃塞的棕色细口试剂瓶中,且瓶口密封
。
答案:
15. 参考答案
(1)圆底烧瓶 ${H_{2}S + I_{2}\xlongequal{}2HI + S}$
(2)c
(3)${I_{2} + I^{-}⇌ I^{-}_{3}}$
(4)${NaOH}$(答案合理即可)
(5)先停止加热,再停止通入${N_{2}}$
(6)$\frac{117×1.7×57\%}{128}×100\%$
(7)具玻璃塞的棕色细口试剂瓶中,且瓶口密封
命题意图 本题以氢碘酸制备实验为情境,涉及仪器识别、反应方程式书写、操作步骤及产率计算等知识,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(1)步骤ⅰ中${H_{2}S}$与${I_{2}}$反应生成${HI}$和${S}$。
(2)步骤ⅰ中产物分离前先静置,则快速搅拌与固液分离无关,a项错误。步骤ⅰ中的装置未加热,不涉及防暴沸,b项错误。反应中有${S}$生成,快速搅拌可防止${I_{2}}$被固体产物${S}$包覆,阻碍${H_{2}S}$与${I_{2}}$进一步反应,c项正确。
(3)反应生成的${I^{-}}$可以和未参与反应的${I_{2}}$反应生成易溶于水的${I^{-}_{3}}$,促进碘单质的溶解。
(4)步骤ⅱ中通入的${N_{2}}$可将步骤ⅰ中过量的${H_{2}S}$全部排出,${H_{2}S}$具有酸性和还原性,可吸收${H_{2}S}$的试剂有碱性溶液(如氢氧化钠溶液、氨水)、金属盐溶液(如硫酸铜溶液、氯化锌溶液)、氧化性溶液(如铁盐溶液、双氧水)以及有机胺类溶剂(如二乙醇胺)等。
(5)停止加热后,持续通入${N_{2}}$,可维持无氧环境,防止产物${HI}$被氧化,待装置冷却后再停止通入${N_{2}}$。
(6)实际生成的${HI}$的物质的量为$\frac{117\ mL×1.7\ g· mL^{-1}×57\%}{128\ g· mol^{-1}}$,$n({I_{2}})=\frac{127\ g}{2×127\ g· mol^{-1}}=0.5\ mol$,依据碘元素守恒${I_{2}~2HI}$,则${HI}$的理论产量为$0.5\ mol×2=1\ mol$。故本实验${HI}$的产率为$\frac{\frac{117\ mL×1.7\ g· mL^{-1}×57\%}{128\ g· mol^{-1}}}{1\ mol}×100\%=\frac{117×1.7×57\%}{128}×100\%$。
(7)棕色试剂瓶能有效阻挡可见光,延缓其分解反应。试剂瓶瓶口做好密封,可减少氢碘酸与空气的接触,避免被空气中的氧气氧化。
(1)圆底烧瓶 ${H_{2}S + I_{2}\xlongequal{}2HI + S}$
(2)c
(3)${I_{2} + I^{-}⇌ I^{-}_{3}}$
(4)${NaOH}$(答案合理即可)
(5)先停止加热,再停止通入${N_{2}}$
(6)$\frac{117×1.7×57\%}{128}×100\%$
(7)具玻璃塞的棕色细口试剂瓶中,且瓶口密封
命题意图 本题以氢碘酸制备实验为情境,涉及仪器识别、反应方程式书写、操作步骤及产率计算等知识,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(1)步骤ⅰ中${H_{2}S}$与${I_{2}}$反应生成${HI}$和${S}$。
(2)步骤ⅰ中产物分离前先静置,则快速搅拌与固液分离无关,a项错误。步骤ⅰ中的装置未加热,不涉及防暴沸,b项错误。反应中有${S}$生成,快速搅拌可防止${I_{2}}$被固体产物${S}$包覆,阻碍${H_{2}S}$与${I_{2}}$进一步反应,c项正确。
(3)反应生成的${I^{-}}$可以和未参与反应的${I_{2}}$反应生成易溶于水的${I^{-}_{3}}$,促进碘单质的溶解。
(4)步骤ⅱ中通入的${N_{2}}$可将步骤ⅰ中过量的${H_{2}S}$全部排出,${H_{2}S}$具有酸性和还原性,可吸收${H_{2}S}$的试剂有碱性溶液(如氢氧化钠溶液、氨水)、金属盐溶液(如硫酸铜溶液、氯化锌溶液)、氧化性溶液(如铁盐溶液、双氧水)以及有机胺类溶剂(如二乙醇胺)等。
(5)停止加热后,持续通入${N_{2}}$,可维持无氧环境,防止产物${HI}$被氧化,待装置冷却后再停止通入${N_{2}}$。
(6)实际生成的${HI}$的物质的量为$\frac{117\ mL×1.7\ g· mL^{-1}×57\%}{128\ g· mol^{-1}}$,$n({I_{2}})=\frac{127\ g}{2×127\ g· mol^{-1}}=0.5\ mol$,依据碘元素守恒${I_{2}~2HI}$,则${HI}$的理论产量为$0.5\ mol×2=1\ mol$。故本实验${HI}$的产率为$\frac{\frac{117\ mL×1.7\ g· mL^{-1}×57\%}{128\ g· mol^{-1}}}{1\ mol}×100\%=\frac{117×1.7×57\%}{128}×100\%$。
(7)棕色试剂瓶能有效阻挡可见光,延缓其分解反应。试剂瓶瓶口做好密封,可减少氢碘酸与空气的接触,避免被空气中的氧气氧化。
查看更多完整答案,请扫码查看


