2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第53页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. [2025·河南卷,16T,14分]某研究小组设计了如下实验测定某药用硫黄中硫的含量,其中硫转化的总反应为${S + 2OH^{-} + 3H_{2}O_{2} = SO^{2-}_{4} + 4H_{2}O}$。
主要实验步骤如下:

Ⅰ. 如图所示,准确称取$m\ g$细粉状药用硫黄于①中,并准确加入$V_{1}\ mL\ KOH$乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。
Ⅱ. 室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量$30\%\ H_{2}O_{2}$溶液,加热至$100\ ^{\circ}C$,保持$20\ min$,冷却至室温。
Ⅲ. 将①中溶液全部转移至锥形瓶中,加入$2$滴甲基橙指示剂,用$c\ mol· L^{-1}\ HCl$标准溶液滴定至终点,消耗$HCl$溶液体积为$V_{2}\ mL$。
Ⅳ. 不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_{3}\ mL$。计算样品中硫的质量分数。
Ⅴ. 平行测定三次,计算硫含量的平均值。
回答下列问题:
(1)仪器①的名称是
(2)步骤Ⅰ中,乙醇的作用是
(3)步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是
(4)步骤Ⅱ中不宜采用水浴加热的原因是
(5)步骤Ⅲ中,判断滴定达到终点的现象为
(6)单次样品测定中硫的质量分数可表示为
主要实验步骤如下:

Ⅰ. 如图所示,准确称取$m\ g$细粉状药用硫黄于①中,并准确加入$V_{1}\ mL\ KOH$乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。
Ⅱ. 室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量$30\%\ H_{2}O_{2}$溶液,加热至$100\ ^{\circ}C$,保持$20\ min$,冷却至室温。
Ⅲ. 将①中溶液全部转移至锥形瓶中,加入$2$滴甲基橙指示剂,用$c\ mol· L^{-1}\ HCl$标准溶液滴定至终点,消耗$HCl$溶液体积为$V_{2}\ mL$。
Ⅳ. 不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗$HCl$标准溶液体积为$V_{3}\ mL$。计算样品中硫的质量分数。
Ⅴ. 平行测定三次,计算硫含量的平均值。
回答下列问题:
(1)仪器①的名称是
圆底烧瓶
;②的名称是球形冷凝管
。(2)步骤Ⅰ中,乙醇的作用是
作溶剂,溶解硫黄,使反应物之间接触更充分,加快反应速率
。(3)步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是
防止${H_{2}O_{2}}$溶液氧化乙醇,影响实验测定结果
。(4)步骤Ⅱ中不宜采用水浴加热的原因是
实验需要加热至$100\ ^{\circ} C$,水浴加热无法维持
。步骤Ⅱ结束后,若要检验反应后溶液中的$SO^{2-}_{4}$,实验操作是取少量步骤II反应后的溶液,先加入盐酸酸化,无明显实验现象,再加入氯化钡溶液,若产生白色沉淀,说明含有${SO^{2-}_{4}}$
。(5)步骤Ⅲ中,判断滴定达到终点的现象为
滴入最后半滴${HCl}$标准溶液,溶液颜色恰好由黄色变为橙色,且半分钟内不变色
。(6)单次样品测定中硫的质量分数可表示为
$\dfrac{1.6c(V_{3}-V_{2})}{m}\%$
(写出计算式)。
答案:
1. 参考答案
(1)圆底烧瓶 球形冷凝管
(2)作溶剂,溶解硫黄,使反应物之间接触更充分,加快反应速率
(3)防止${H_{2}O_{2}}$溶液氧化乙醇,影响实验测定结果
(4)实验需要加热至$100\ ^{\circ} C$,水浴加热无法维持。取少量步骤II反应后的溶液,先加入盐酸酸化,无明显实验现象,再加入氯化钡溶液,若产生白色沉淀,说明含有${SO^{2-}_{4}}$
(5)滴入最后半滴${HCl}$标准溶液,溶液颜色恰好由黄色变为橙色,且半分钟内不变色
(6)$\dfrac{1.6c(V_{3}-V_{2})}{m}\%$
命题意图本题通过硫含量测定实验,考查实验仪器、实验操作与目的、离子检验、滴定终点判断及质量分数计算,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(2)硫单质难溶于水,微溶于酒精,所以乙醇的作用是作溶剂,溶解硫黄,使反应物之间接触更充分,加快反应速率。
(3)${H_{2}O_{2}}$具有强氧化性,乙醇具有还原性,二者混合发生氧化还原反应,反应产物会对后续滴定过程造成干扰,所以样品完全溶解后,必须蒸馏除去乙醇。
(5)甲基橙的变色范围为$3.1\sim4.4$,${pH}$在$4.4$以上呈黄色,${pH}$在$3.1\sim4.4$呈橙色。滴定过程中溶液由碱性变为中性,再滴入半滴盐酸使溶液变为弱酸性,故滴定终点现象为溶液由黄色变为橙色,且半分钟内不变色。
(6)不加入硫黄,重复步骤I、II、III做空白实验,消耗${HCl}$标准溶液体积为$V_{3}\ {mL}$,则初始加入的$n_{0}({KOH})=0.001cV_{3}\ {mol}$,步骤II反应后$n_{ 剩余}({KOH})=0.001cV_{2}\ {mol}$,因此与硫黄反应的$n_{ 反应}({KOH})=0.001c(V_{3}-V_{2})\ {mol}$,根据${S\sim 2OH^{-}}$可得,$n({S})=\dfrac{1}{2}n_{ 反应}({KOH})=0.0005c(V_{3}-V_{2})\ {mol}$,所以单次样品测定中硫的质量分数可表示为$\dfrac{0.0005c(V_{3}-V_{2})×32}{m}×100\%=\dfrac{1.6c(V_{3}-V_{2})}{m}\%$。
(1)圆底烧瓶 球形冷凝管
(2)作溶剂,溶解硫黄,使反应物之间接触更充分,加快反应速率
(3)防止${H_{2}O_{2}}$溶液氧化乙醇,影响实验测定结果
(4)实验需要加热至$100\ ^{\circ} C$,水浴加热无法维持。取少量步骤II反应后的溶液,先加入盐酸酸化,无明显实验现象,再加入氯化钡溶液,若产生白色沉淀,说明含有${SO^{2-}_{4}}$
(5)滴入最后半滴${HCl}$标准溶液,溶液颜色恰好由黄色变为橙色,且半分钟内不变色
(6)$\dfrac{1.6c(V_{3}-V_{2})}{m}\%$
命题意图本题通过硫含量测定实验,考查实验仪器、实验操作与目的、离子检验、滴定终点判断及质量分数计算,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(2)硫单质难溶于水,微溶于酒精,所以乙醇的作用是作溶剂,溶解硫黄,使反应物之间接触更充分,加快反应速率。
(3)${H_{2}O_{2}}$具有强氧化性,乙醇具有还原性,二者混合发生氧化还原反应,反应产物会对后续滴定过程造成干扰,所以样品完全溶解后,必须蒸馏除去乙醇。
(5)甲基橙的变色范围为$3.1\sim4.4$,${pH}$在$4.4$以上呈黄色,${pH}$在$3.1\sim4.4$呈橙色。滴定过程中溶液由碱性变为中性,再滴入半滴盐酸使溶液变为弱酸性,故滴定终点现象为溶液由黄色变为橙色,且半分钟内不变色。
(6)不加入硫黄,重复步骤I、II、III做空白实验,消耗${HCl}$标准溶液体积为$V_{3}\ {mL}$,则初始加入的$n_{0}({KOH})=0.001cV_{3}\ {mol}$,步骤II反应后$n_{ 剩余}({KOH})=0.001cV_{2}\ {mol}$,因此与硫黄反应的$n_{ 反应}({KOH})=0.001c(V_{3}-V_{2})\ {mol}$,根据${S\sim 2OH^{-}}$可得,$n({S})=\dfrac{1}{2}n_{ 反应}({KOH})=0.0005c(V_{3}-V_{2})\ {mol}$,所以单次样品测定中硫的质量分数可表示为$\dfrac{0.0005c(V_{3}-V_{2})×32}{m}×100\%=\dfrac{1.6c(V_{3}-V_{2})}{m}\%$。
2. [2025·辽宁卷,17T,13分]某实验小组采用如下方案实现了对甲基苯甲酸的绿色制备。

步骤:
Ⅰ. 向反应管中加入$0.12\ g$对甲基苯甲醛和$1.0\ mL$丙酮,光照,连续监测反应进程。
Ⅱ.$5\ h$时,监测结果显示反应基本结束,蒸去溶剂丙酮,加入过量稀$NaOH$溶液,充分反应后,用乙酸乙酯洗涤,弃去有机层。
Ⅲ. 用稀盐酸调节水层$pH = 1$后,再用乙酸乙酯萃取。
Ⅳ. 用饱和食盐水洗涤有机层,无水$Na_{2}SO_{4}$干燥,过滤,蒸去溶剂,得目标产物。
回答下列问题:
(1)相比$KMnO_{4}$作氧化剂,该制备反应的优点为
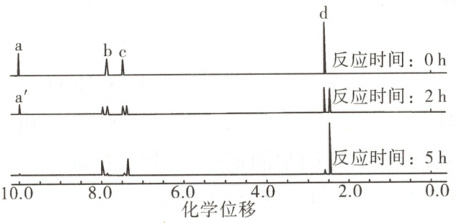
(2)根据反应液的核磁共振氢谱(已去除溶剂$H$的吸收峰,谱图中无羧基$H$的吸收峰)监测反应进程如下图。已知峰面积比$a:b:c:d = 1:2:2:3$,$a:a' = 2:1$。反应$2\ h$时,对甲基苯甲醛转化率约为
(3)步骤Ⅱ中使用乙酸乙酯洗涤的目的是
(4)步骤Ⅲ中反应的离子方程式为
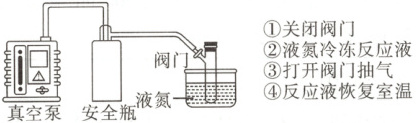
(5)用同位素示踪法确定产物羧基$O$的来源。丙酮易挥发,为保证$^{18}O_{2}$气氛,通$^{18}O_{2}$前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的$^{16}O_{2}$,操作顺序为:①→②→
同位素示踪结果如下表所示,则目标产物中羧基$O$来源于醛基和


步骤:
Ⅰ. 向反应管中加入$0.12\ g$对甲基苯甲醛和$1.0\ mL$丙酮,光照,连续监测反应进程。
Ⅱ.$5\ h$时,监测结果显示反应基本结束,蒸去溶剂丙酮,加入过量稀$NaOH$溶液,充分反应后,用乙酸乙酯洗涤,弃去有机层。
Ⅲ. 用稀盐酸调节水层$pH = 1$后,再用乙酸乙酯萃取。
Ⅳ. 用饱和食盐水洗涤有机层,无水$Na_{2}SO_{4}$干燥,过滤,蒸去溶剂,得目标产物。
回答下列问题:
(1)相比$KMnO_{4}$作氧化剂,该制备反应的优点为
利用空气作氧化剂绿色环保
、避免甲基同时被${KMnO_{4}}$氧化
(答出$2$条即可)。(2)根据反应液的核磁共振氢谱(已去除溶剂$H$的吸收峰,谱图中无羧基$H$的吸收峰)监测反应进程如下图。已知峰面积比$a:b:c:d = 1:2:2:3$,$a:a' = 2:1$。反应$2\ h$时,对甲基苯甲醛转化率约为
$50$
$\%$。
(3)步骤Ⅱ中使用乙酸乙酯洗涤的目的是
除去未反应完的${H_{3}C - ◯ - CHO}$





 ,便于分离出产品
,便于分离出产品
。





 ,便于分离出产品
,便于分离出产品(4)步骤Ⅲ中反应的离子方程式为
${H^{+} + OH^{-}\xlongequal{}H_{2}O}$
、${H_{3}C - ◯ - COO^{-} + H^{+}\longrightarrow H_{3}C - ◯ - COOH}$
。(5)用同位素示踪法确定产物羧基$O$的来源。丙酮易挥发,为保证$^{18}O_{2}$气氛,通$^{18}O_{2}$前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的$^{16}O_{2}$,操作顺序为:①→②→
③
→①
→④
(填标号),重复后四步操作数次。
同位素示踪结果如下表所示,则目标产物中羧基$O$来源于醛基和
${O_{2}}$
。
答案:
2. 参考答案
(1)利用空气作氧化剂绿色环保 避免甲基同时被${KMnO_{4}}$氧化
(2)$50$
(3)除去未反应完的${H_{3}C - ◯ - CHO}$





 ,便于分离出产品
,便于分离出产品
(4)${H^{+} + OH^{-}\xlongequal{}H_{2}O}$ ${H_{3}C - ◯ - COO^{-} + H^{+}\longrightarrow H_{3}C - ◯ - COOH}$
(5)③ ① ④ ${O_{2}}$
命题意图本题以对甲基苯甲酸的绿色制备实验为情境,并与核磁共振氢谱、同位素示踪法相结合,考查实验操作与目的、转化率计算等知识,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(2)起始$0\ {h}$时,反应液中只有${H_{3}C - ◯ - CHO}$,$5\ {h}$时反应基本结束,此时$ a$峰消失,说明$ a$对应的是${-CHO}$中${H}$的化学位移,峰面积之比为不同化学环境的氢的物质的量之比。反应过程中${H_{3}C - ◯ - CHO}$转化为${H_{3}C - ◯ - COOH}$,谱图中无羧基${H}$的吸收峰,则反应$2\ {h}$时,$ a: a'=2:1$,说明$2\ {h}$时反应液中剩余的${H_{3}C - ◯ - CHO}$的物质的量是起始物质的量的$\dfrac{1}{2}$,即反应$2\ {h}$转化的${H_{3}C - ◯ - CHO}$的物质的量是起始物质的量的$\dfrac{1}{2}$,对甲基苯甲醛转化率约为$50\%$。
(3)蒸去溶剂丙酮后,加入过量稀${NaOH}$溶液将对甲基苯甲酸转化为对甲基苯甲酸钠进入水层,则充分反应后,用乙酸乙酯洗涤的目的是除去未反应完的${H_{3}C - ◯ - CHO}$,便于分离出产品。
(5)为保证${^{18}O_{2}}$气氛,通${^{18}O_{2}}$前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的${^{16}O_{2}}$,由于丙酮易挥发,故应先用液氮冷冻丙酮,再抽出${^{16}O_{2}}$,然后关闭阀门,恢复室温,使${^{16}O_{2}}$排出,所以操作顺序为①$\to$②$\to$③$\to$①$\to$④,重复后四步操作数次。使用${^{18}O_{2}}$、${CH_{3}COCH_{3}}$得到的目标产物相对分子质量为$138$,使用空气、${CH_{3}C^{18}OCH_{3}}$得到的目标产物相对分子质量为$136$,说明目标产物中羧基${O}$来源于醛基和氧气。
2. 参考答案
(1)利用空气作氧化剂绿色环保 避免甲基同时被${KMnO_{4}}$氧化
(2)$50$
(3)除去未反应完的${H_{3}C - ◯ - CHO}$






 ,便于分离出产品
,便于分离出产品(4)${H^{+} + OH^{-}\xlongequal{}H_{2}O}$ ${H_{3}C - ◯ - COO^{-} + H^{+}\longrightarrow H_{3}C - ◯ - COOH}$
(5)③ ① ④ ${O_{2}}$
命题意图本题以对甲基苯甲酸的绿色制备实验为情境,并与核磁共振氢谱、同位素示踪法相结合,考查实验操作与目的、转化率计算等知识,体现了“科学探究与创新意识”等化学学科核心素养。
解题思路
(2)起始$0\ {h}$时,反应液中只有${H_{3}C - ◯ - CHO}$,$5\ {h}$时反应基本结束,此时$ a$峰消失,说明$ a$对应的是${-CHO}$中${H}$的化学位移,峰面积之比为不同化学环境的氢的物质的量之比。反应过程中${H_{3}C - ◯ - CHO}$转化为${H_{3}C - ◯ - COOH}$,谱图中无羧基${H}$的吸收峰,则反应$2\ {h}$时,$ a: a'=2:1$,说明$2\ {h}$时反应液中剩余的${H_{3}C - ◯ - CHO}$的物质的量是起始物质的量的$\dfrac{1}{2}$,即反应$2\ {h}$转化的${H_{3}C - ◯ - CHO}$的物质的量是起始物质的量的$\dfrac{1}{2}$,对甲基苯甲醛转化率约为$50\%$。
(3)蒸去溶剂丙酮后,加入过量稀${NaOH}$溶液将对甲基苯甲酸转化为对甲基苯甲酸钠进入水层,则充分反应后,用乙酸乙酯洗涤的目的是除去未反应完的${H_{3}C - ◯ - CHO}$,便于分离出产品。
(5)为保证${^{18}O_{2}}$气氛,通${^{18}O_{2}}$前,需先使用“循环冷冻脱气法”排出装置中(空气中和溶剂中)的${^{16}O_{2}}$,由于丙酮易挥发,故应先用液氮冷冻丙酮,再抽出${^{16}O_{2}}$,然后关闭阀门,恢复室温,使${^{16}O_{2}}$排出,所以操作顺序为①$\to$②$\to$③$\to$①$\to$④,重复后四步操作数次。使用${^{18}O_{2}}$、${CH_{3}COCH_{3}}$得到的目标产物相对分子质量为$138$,使用空气、${CH_{3}C^{18}OCH_{3}}$得到的目标产物相对分子质量为$136$,说明目标产物中羧基${O}$来源于醛基和氧气。
查看更多完整答案,请扫码查看


