2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第6页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
16. (14分)铬盐产品广泛应用于化工、医药、印染等领域。通过闭环生产工艺将铬铁矿转化为重铬酸钾同时回收利用钾资源,可实现绿色化学的目标。过程如下:
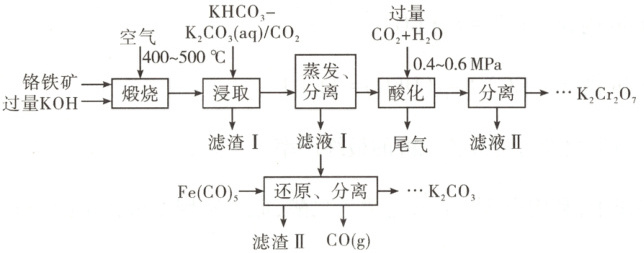
已知:铬铁矿主要成分是$Fe(CrO_{2})_{2}$、$Mg(CrO_{2})_{2}$、$Al_{2}O_{3}$、$SiO_{2}$。
回答下列问题:
(1)基态铬原子的价层电子排布式:
(2)煅烧工序中$Fe(CrO_{2})_{2}$反应生成$K_{2}CrO_{4}$的化学方程式:
(3)浸取工序中滤渣Ⅰ的主要成分:$Fe_{2}O_{3}$、$H_{2}SiO_{3}$、
(4)酸化工序中需加压的原因:
(5)滤液Ⅱ的主要成分:
(6)补全还原、分离工序中发生反应的化学方程式$Fe(CO)_{5}+$
(7)滤渣Ⅱ可返回

已知:铬铁矿主要成分是$Fe(CrO_{2})_{2}$、$Mg(CrO_{2})_{2}$、$Al_{2}O_{3}$、$SiO_{2}$。
回答下列问题:
(1)基态铬原子的价层电子排布式:
3d⁵4s¹
。(2)煅烧工序中$Fe(CrO_{2})_{2}$反应生成$K_{2}CrO_{4}$的化学方程式:
4Fe(CrO₂)₂ + 7O₂ + 16KOH = 8K₂CrO₄ + 2Fe₂O₃ + 8H₂O
。(3)浸取工序中滤渣Ⅰ的主要成分:$Fe_{2}O_{3}$、$H_{2}SiO_{3}$、
MgO
、Al(OH)₃
(填化学式)。(4)酸化工序中需加压的原因:
增大CO₂的溶解度,保证酸化反应充分进行
。(5)滤液Ⅱ的主要成分:
KHCO₃
(填化学式)。(6)补全还原、分离工序中发生反应的化学方程式$Fe(CO)_{5}+$
K₂CrO₄
+$=$$Cr(OH)_{3}\downarrow+$2KHCO₃
+$+$$CO\uparrow$。(7)滤渣Ⅱ可返回
煅烧
工序。(填工序名称)
答案:
16. 参考答案
(1)${3d^{5}4s^{1}}$
(2)${4Fe(CrO_{2})_{2} + 7O_{2} + 16KOH\xlongequal{400~500\ ^{\circ} C}8K_{2}CrO_{4} + 2Fe_{2}O_{3} + 8H_{2}O}$
(3)${MgO}$ ${Al(OH)_{3}}$
(4)增大${CO_{2}}$的溶解度,保证酸化反应充分进行
(5)${KHCO_{3}}$
(6)${K_{2}CrO_{4} + 2CO_{2} + 2H_{2}O = K_{2}Cr_{2}O_{7} + 2KHCO_{3}}$
(7)煅烧
命题意图 本题以铬元素及其化合物的制备同时回收利用钾资源的过程为情境,考查元素及产品的性质,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 铬铁矿与过量${KOH}$在空气中煅烧,${Fe(CrO_{2})_{2}}$、${Mg(CrO_{2})_{2}}$、${KOH}$和${O_{2}}$反应转化为${Fe_{2}O_{3}}$、${MgO}$、${K_{2}CrO_{4}}$,而${Al_{2}O_{3}}$、${SiO_{2}}$分别与过量的${KOH}$反应,转化为${KAlO_{2}}$、${K_{2}SiO_{3}}$。加入${KHCO_{3}-K_{2}CO_{3}}$的混合溶液,同时通入${CO_{2}}$进行浸取,${KAlO_{2}}$、${K_{2}SiO_{3}}$与${CO_{2}}$反应,分别转化为${Al(OH)_{3}}$沉淀、${H_{2}SiO_{3}}$沉淀,${Fe_{2}O_{3}}$、${MgO}$与${KHCO_{3}-K_{2}CO_{3}(aq)}$、${CO_{2}}$均不反应,则滤渣Ⅰ的主要成分为${Fe_{2}O_{3}}$、${H_{2}SiO_{3}}$、${MgO}$、${Al(OH)_{3}}$。通过蒸发浓缩、冷却结晶、过滤,分离出${K_{2}CrO_{4}}$固体,滤液Ⅰ中含有${K_{2}CO_{3}}$和少量${K_{2}CrO_{4}}$。向${K_{2}CrO_{4}}$固体中加水溶解,并通入过量${CO_{2}}$提供酸性环境,将${K_{2}CrO_{4}}$转化为${K_{2}Cr_{2}O_{7}}$,同时有副产物${KHCO_{3}}$生成(反应方程式为${K_{2}CrO_{4} + 2CO_{2} + 2H_{2}O = K_{2}Cr_{2}O_{7} + 2KHCO_{3}}$)。将${K_{2}Cr_{2}O_{7}}$与${KHCO_{3}}$分离,滤液Ⅱ的主要成分为${KHCO_{3}}$。还原、分离工序中${Fe(CO)_{5}}$作还原剂,将滤液Ⅰ中剩余的${K_{2}CrO_{4}}$还原为${Cr(OH)_{3}}$,自身转化为${Fe(OH)_{3}}$沉淀,同时生成${CO}$和${KOH}$,其中${Fe(OH)_{3}}$和${Cr(OH)_{3}}$进入滤渣Ⅱ,${KOH}$进一步处理得到${K_{2}CO_{3}}$。
(1)铬是24号元素,其基态原子的核外电子排布符合洪特规则特例,价层电子排布式为${3d^{5}4s^{1}}$。
(4)通入过量${CO_{2}}$的目的是提供酸性环境,使${K_{2}CrO_{4}}$转化为${K_{2}Cr_{2}O_{7}}$,加压可以增大${CO_{2}}$的溶解度,使更多的${CO_{2}}$溶解在溶液中,从而保证酸化反应充分进行,提高酸化反应速率和${K_{2}CrO_{4}}$的转化率。
(7)滤渣Ⅱ主要成分是${Cr(OH)_{3}}$、${Fe(OH)_{3}}$,可返回煅烧工序,节约原料,实现绿色化学。
(1)${3d^{5}4s^{1}}$
(2)${4Fe(CrO_{2})_{2} + 7O_{2} + 16KOH\xlongequal{400~500\ ^{\circ} C}8K_{2}CrO_{4} + 2Fe_{2}O_{3} + 8H_{2}O}$
(3)${MgO}$ ${Al(OH)_{3}}$
(4)增大${CO_{2}}$的溶解度,保证酸化反应充分进行
(5)${KHCO_{3}}$
(6)${K_{2}CrO_{4} + 2CO_{2} + 2H_{2}O = K_{2}Cr_{2}O_{7} + 2KHCO_{3}}$
(7)煅烧
命题意图 本题以铬元素及其化合物的制备同时回收利用钾资源的过程为情境,考查元素及产品的性质,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 铬铁矿与过量${KOH}$在空气中煅烧,${Fe(CrO_{2})_{2}}$、${Mg(CrO_{2})_{2}}$、${KOH}$和${O_{2}}$反应转化为${Fe_{2}O_{3}}$、${MgO}$、${K_{2}CrO_{4}}$,而${Al_{2}O_{3}}$、${SiO_{2}}$分别与过量的${KOH}$反应,转化为${KAlO_{2}}$、${K_{2}SiO_{3}}$。加入${KHCO_{3}-K_{2}CO_{3}}$的混合溶液,同时通入${CO_{2}}$进行浸取,${KAlO_{2}}$、${K_{2}SiO_{3}}$与${CO_{2}}$反应,分别转化为${Al(OH)_{3}}$沉淀、${H_{2}SiO_{3}}$沉淀,${Fe_{2}O_{3}}$、${MgO}$与${KHCO_{3}-K_{2}CO_{3}(aq)}$、${CO_{2}}$均不反应,则滤渣Ⅰ的主要成分为${Fe_{2}O_{3}}$、${H_{2}SiO_{3}}$、${MgO}$、${Al(OH)_{3}}$。通过蒸发浓缩、冷却结晶、过滤,分离出${K_{2}CrO_{4}}$固体,滤液Ⅰ中含有${K_{2}CO_{3}}$和少量${K_{2}CrO_{4}}$。向${K_{2}CrO_{4}}$固体中加水溶解,并通入过量${CO_{2}}$提供酸性环境,将${K_{2}CrO_{4}}$转化为${K_{2}Cr_{2}O_{7}}$,同时有副产物${KHCO_{3}}$生成(反应方程式为${K_{2}CrO_{4} + 2CO_{2} + 2H_{2}O = K_{2}Cr_{2}O_{7} + 2KHCO_{3}}$)。将${K_{2}Cr_{2}O_{7}}$与${KHCO_{3}}$分离,滤液Ⅱ的主要成分为${KHCO_{3}}$。还原、分离工序中${Fe(CO)_{5}}$作还原剂,将滤液Ⅰ中剩余的${K_{2}CrO_{4}}$还原为${Cr(OH)_{3}}$,自身转化为${Fe(OH)_{3}}$沉淀,同时生成${CO}$和${KOH}$,其中${Fe(OH)_{3}}$和${Cr(OH)_{3}}$进入滤渣Ⅱ,${KOH}$进一步处理得到${K_{2}CO_{3}}$。
(1)铬是24号元素,其基态原子的核外电子排布符合洪特规则特例,价层电子排布式为${3d^{5}4s^{1}}$。
(4)通入过量${CO_{2}}$的目的是提供酸性环境,使${K_{2}CrO_{4}}$转化为${K_{2}Cr_{2}O_{7}}$,加压可以增大${CO_{2}}$的溶解度,使更多的${CO_{2}}$溶解在溶液中,从而保证酸化反应充分进行,提高酸化反应速率和${K_{2}CrO_{4}}$的转化率。
(7)滤渣Ⅱ主要成分是${Cr(OH)_{3}}$、${Fe(OH)_{3}}$,可返回煅烧工序,节约原料,实现绿色化学。
17. (15分)乙二醇$(EG)$是一种重要的基础化工原料,可通过石油化工和煤化工等工业路线合成。
(1)石油化工路线中,环氧乙烷$(EO)$水合工艺是一种成熟的乙二醇生产方法,环氧乙烷和水反应生成乙二醇,伴随生成二乙二醇$(DEG)$的副反应。
主反应:$EO(aq)+H_{2}O(l)=EG(aq)\ \ \Delta H<0$
副反应:$EO(aq)+EG(aq)=DEG(aq)$
体系中环氧乙烷初始浓度为$1.5\ mol· L^{-1}$,恒温下反应$30\ min$,环氧乙烷完全转化,产物中$n(EG):n(DEG)=10:1$。
①$0\sim30\ min$内,$v_{总}(EO)=$
②下列说法正确的是
a. 主反应中,生成物总能量高于反应物总能量
b. $0\sim30\ min$内,$v_{总}(EO)=v_{总}(EG)$
c. $0\sim30\ min$内,$v_{主}(EG):v_{副}(DEG)=11:1$
d. 选择适当催化剂可提高乙二醇的最终产率
(2)煤化工路线中,利用合成气直接合成乙二醇,原子利用率可达$100\%$,具有广阔的发展前景。
反应如下:
$2CO(g)+3H_{2}(g)\rightleftharpoons HOCH_{2}CH_{2}OH(g)\ \ \Delta H$
按化学计量比进料,固定平衡转化率$\alpha$,探究温度与压强的关系。$\alpha$分别为$0.4$、$0.5$和$0.6$时,温度与压强的关系如图:
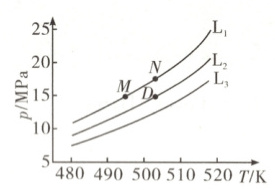
①代表$\alpha = 0.6$的曲线为
②$\Delta H$
③已知:反应$aA(g)+bB(g)\rightleftharpoons yY(g)+zZ(g)$,$K_{x}=\frac{x^{y}(Y)x^{z}(Z)}{x^{a}(A)x^{b}(B)}$,$x$为组分的物质的量分数。
$M$、$N$两点对应的体系,$K_{x}(M)$
④已知:反应$aA(g)+bB(g)\rightleftharpoons yY(g)+zZ(g)$,$K_{p}=\frac{p^{y}(Y)p^{z}(Z)}{p^{a}(A)p^{b}(B)}$,$p$为组分的分压。调整进料比为$n(CO):n(H_{2})=m:3$,系统压强维持$p_{0}\ MPa$,使$\alpha(H_{2}) = 0.75$,此时$K_{p}=$
(1)石油化工路线中,环氧乙烷$(EO)$水合工艺是一种成熟的乙二醇生产方法,环氧乙烷和水反应生成乙二醇,伴随生成二乙二醇$(DEG)$的副反应。
主反应:$EO(aq)+H_{2}O(l)=EG(aq)\ \ \Delta H<0$
副反应:$EO(aq)+EG(aq)=DEG(aq)$
体系中环氧乙烷初始浓度为$1.5\ mol· L^{-1}$,恒温下反应$30\ min$,环氧乙烷完全转化,产物中$n(EG):n(DEG)=10:1$。
①$0\sim30\ min$内,$v_{总}(EO)=$
0.05
$mol· L^{-1}· min^{-1}$。②下列说法正确的是
cd
(填序号)。a. 主反应中,生成物总能量高于反应物总能量
b. $0\sim30\ min$内,$v_{总}(EO)=v_{总}(EG)$
c. $0\sim30\ min$内,$v_{主}(EG):v_{副}(DEG)=11:1$
d. 选择适当催化剂可提高乙二醇的最终产率
(2)煤化工路线中,利用合成气直接合成乙二醇,原子利用率可达$100\%$,具有广阔的发展前景。
反应如下:
$2CO(g)+3H_{2}(g)\rightleftharpoons HOCH_{2}CH_{2}OH(g)\ \ \Delta H$
按化学计量比进料,固定平衡转化率$\alpha$,探究温度与压强的关系。$\alpha$分别为$0.4$、$0.5$和$0.6$时,温度与压强的关系如图:

①代表$\alpha = 0.6$的曲线为
L₁
(填“$L_{1}$”“$L_{2}$”或“$L_{3}$”);原因是该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大
。②$\Delta H$
<
$0$(填“$>$”“$<$”或“$=$”)。③已知:反应$aA(g)+bB(g)\rightleftharpoons yY(g)+zZ(g)$,$K_{x}=\frac{x^{y}(Y)x^{z}(Z)}{x^{a}(A)x^{b}(B)}$,$x$为组分的物质的量分数。
$M$、$N$两点对应的体系,$K_{x}(M)$
=
$K_{x}(N)$(填“$>$”“$<$”或“$=$”),$D$点对应体系的$K_{x}$的值为12
。④已知:反应$aA(g)+bB(g)\rightleftharpoons yY(g)+zZ(g)$,$K_{p}=\frac{p^{y}(Y)p^{z}(Z)}{p^{a}(A)p^{b}(B)}$,$p$为组分的分压。调整进料比为$n(CO):n(H_{2})=m:3$,系统压强维持$p_{0}\ MPa$,使$\alpha(H_{2}) = 0.75$,此时$K_{p}=$
1/[( (m-1.5)/m × p₀ )² × (0.75/m × p₀)²]
$MPa^{-4}$(用含有$m$和$p_{0}$的代数式表示)。
答案:
17. 参考答案
(1)①0.05 ②cd
(2)①${L_{1}}$ 该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大 ②< ③= 12 ④$\frac{1}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{2}}$
命题意图 本题以乙二醇的制备为情境,考查化学反应速率与化学平衡的移动,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路
(1)①反应30 min,环氧乙烷完全转化,则0~30 min内$v_{ 总}({EO})=\frac{1.5\ mol· L^{-1}}{30\ min}=0.05\ mol· L^{-1}· min^{-1}$。 ②$\Delta H=$生成物总能量-反应物总能量,主反应$\Delta H<0$,则生成物总能量低于反应物总能量,a项错误。主反应伴随副反应发生,${EG}$作为主反应的生成物,同时也是副反应的反应物,即${EG}$的浓度变化量小于${EO}$的浓度变化量,$v_{ 总}({EO})>v_{ 总}({EG})$,b项错误。同一反应体系中物质的量变化之比等于化学计量数之比,产物中$n({EG}):n({DEG})=10:1$,即$\Delta n({EG}):\Delta n({DEG})=10:1$,$v_{ 总}({EG})=v_{ 主}({EG})-v_{ 副}({EG})$,反应时间相同,则$v_{ 总}({EG}):v_{ 副}({DEG})=10:1$,即$\frac{v_{ 主}({EG})-v_{ 副}({EG})}{v_{ 副}({DEG})}=\frac{10}{1}$,副反应中$v_{ 副}({EG})=v_{ 副}({DEG})$,则$v_{ 主}({EG}):v_{ 副}({DEG})=11:1$,c项正确。选择适当催化剂提高主反应的选择性,从而提高乙二醇的最终产率,d项正确。
(2)①该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大,$p({L_{1}})>p({L_{2}})>p({L_{3}})$,${L_{1}}$、${L_{2}}$、${L_{3}}$对应的$\alpha$依次为0.6、0.5、0.4。 ②由图可知,压强相同时,温度越高,平衡转化率越低,说明升高温度,平衡逆向移动,则正反应为放热反应,$\Delta H<0$。 ③M、N的进料相同,平衡转化率相等,即平衡时各组分物质的量分数分别相等,则$K_{x}({M})=K_{x}({N})$。D点对应的平衡转化率为0.5,按化学计量比进料,设起始加入2 mol ${CO}$、3 mol ${H_{2}}$,列三段式: ${2CO(g) + 3H_{2}(g)⇌ HOCH_{2}CH_{2}OH(g)}$ 起始/mol 2 3 0 转化/mol 1 1.5 0.5 平衡/mol 1 1.5 0.5 平衡时${CO}$、${H_{2}}$、${HOCH_{2}CH_{2}OH}$的物质的量分数分别为$\frac{1}{3}$、$\frac{1}{2}$、$\frac{1}{6}$,$K_{x}({D})=\frac{\frac{1}{6}}{(\frac{1}{3})^{2}×(\frac{1}{2})^{3}}=12$。 ④设起始加入$m$ mol ${CO}$、3 mol ${H_{2}}$,此时$\alpha({H_{2}})=0.75$,列三段式: ${2CO(g) + 3H_{2}(g)⇌ HOCH_{2}CH_{2}OH(g)}$ 起始/mol $m$ 3 0 转化/mol 1.5 2.25 0.75 平衡/mol $m - 1.5$ 0.75 0.75 系统压强维持$p_{0}\ MPa$,平衡时气体总物质的量为$m\ mol$,则${CO}$、${H_{2}}$、${HOCH_{2}CH_{2}OH}$的平衡分压分别为$\frac{m - 1.5}{m}p_{0}\ MPa$、$\frac{0.75}{m}p_{0}\ MPa$、$\frac{0.75}{m}p_{0}\ MPa$,此时$K_{p}=\frac{\frac{0.75}{m}p_{0}}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{3}}\ MPa^{-4}=\frac{1}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{2}}\ MPa^{-4}$。
易错提醒
在一定的温度和压强范围内,对于一个指定的有气体参加或生成的化学反应,$K_{c}$和$K_{p}$的大小仅和温度有关;但$K_{x}$不仅和温度有关,还和总压有关,当温度、压强同时改变时,可能存在$K_{x}$不变的情况。对反应前后气体物质的量不变的反应,其$K_{x}$与总压无关。
(1)①0.05 ②cd
(2)①${L_{1}}$ 该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大 ②< ③= 12 ④$\frac{1}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{2}}$
命题意图 本题以乙二醇的制备为情境,考查化学反应速率与化学平衡的移动,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路
(1)①反应30 min,环氧乙烷完全转化,则0~30 min内$v_{ 总}({EO})=\frac{1.5\ mol· L^{-1}}{30\ min}=0.05\ mol· L^{-1}· min^{-1}$。 ②$\Delta H=$生成物总能量-反应物总能量,主反应$\Delta H<0$,则生成物总能量低于反应物总能量,a项错误。主反应伴随副反应发生,${EG}$作为主反应的生成物,同时也是副反应的反应物,即${EG}$的浓度变化量小于${EO}$的浓度变化量,$v_{ 总}({EO})>v_{ 总}({EG})$,b项错误。同一反应体系中物质的量变化之比等于化学计量数之比,产物中$n({EG}):n({DEG})=10:1$,即$\Delta n({EG}):\Delta n({DEG})=10:1$,$v_{ 总}({EG})=v_{ 主}({EG})-v_{ 副}({EG})$,反应时间相同,则$v_{ 总}({EG}):v_{ 副}({DEG})=10:1$,即$\frac{v_{ 主}({EG})-v_{ 副}({EG})}{v_{ 副}({DEG})}=\frac{10}{1}$,副反应中$v_{ 副}({EG})=v_{ 副}({DEG})$,则$v_{ 主}({EG}):v_{ 副}({DEG})=11:1$,c项正确。选择适当催化剂提高主反应的选择性,从而提高乙二醇的最终产率,d项正确。
(2)①该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大,$p({L_{1}})>p({L_{2}})>p({L_{3}})$,${L_{1}}$、${L_{2}}$、${L_{3}}$对应的$\alpha$依次为0.6、0.5、0.4。 ②由图可知,压强相同时,温度越高,平衡转化率越低,说明升高温度,平衡逆向移动,则正反应为放热反应,$\Delta H<0$。 ③M、N的进料相同,平衡转化率相等,即平衡时各组分物质的量分数分别相等,则$K_{x}({M})=K_{x}({N})$。D点对应的平衡转化率为0.5,按化学计量比进料,设起始加入2 mol ${CO}$、3 mol ${H_{2}}$,列三段式: ${2CO(g) + 3H_{2}(g)⇌ HOCH_{2}CH_{2}OH(g)}$ 起始/mol 2 3 0 转化/mol 1 1.5 0.5 平衡/mol 1 1.5 0.5 平衡时${CO}$、${H_{2}}$、${HOCH_{2}CH_{2}OH}$的物质的量分数分别为$\frac{1}{3}$、$\frac{1}{2}$、$\frac{1}{6}$,$K_{x}({D})=\frac{\frac{1}{6}}{(\frac{1}{3})^{2}×(\frac{1}{2})^{3}}=12$。 ④设起始加入$m$ mol ${CO}$、3 mol ${H_{2}}$,此时$\alpha({H_{2}})=0.75$,列三段式: ${2CO(g) + 3H_{2}(g)⇌ HOCH_{2}CH_{2}OH(g)}$ 起始/mol $m$ 3 0 转化/mol 1.5 2.25 0.75 平衡/mol $m - 1.5$ 0.75 0.75 系统压强维持$p_{0}\ MPa$,平衡时气体总物质的量为$m\ mol$,则${CO}$、${H_{2}}$、${HOCH_{2}CH_{2}OH}$的平衡分压分别为$\frac{m - 1.5}{m}p_{0}\ MPa$、$\frac{0.75}{m}p_{0}\ MPa$、$\frac{0.75}{m}p_{0}\ MPa$,此时$K_{p}=\frac{\frac{0.75}{m}p_{0}}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{3}}\ MPa^{-4}=\frac{1}{(\frac{m - 1.5}{m}p_{0})^{2}×(\frac{0.75}{m}p_{0})^{2}}\ MPa^{-4}$。
易错提醒
在一定的温度和压强范围内,对于一个指定的有气体参加或生成的化学反应,$K_{c}$和$K_{p}$的大小仅和温度有关;但$K_{x}$不仅和温度有关,还和总压有关,当温度、压强同时改变时,可能存在$K_{x}$不变的情况。对反应前后气体物质的量不变的反应,其$K_{x}$与总压无关。
查看更多完整答案,请扫码查看


