2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第67页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. [2025·甘肃卷,16T,15分]研究人员设计了一种从铜冶炼烟尘(主要含S、As₂O₃及Cu、Zn、Pb的硫酸盐)中高效回收砷、铜、锌和铅的绿色工艺,部分流程如下:
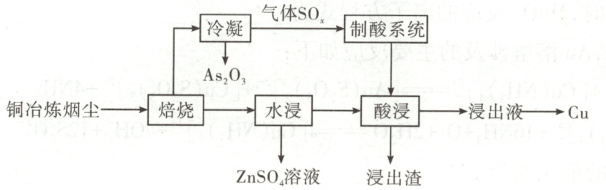
已知:As₂O₃熔点314℃,沸点460℃
分解温度:CuO 1100℃,CuSO₄ 560℃,ZnSO₄ 680℃,PbSO₄高于1000℃
Kₛₚ(PbSO₄)=1.8×10⁻⁸
(1)设计焙烧温度为600℃,理由为
(2)将SO₂通入Na₂CO₃和Na₂S的混合溶液可制得Na₂S₂O₃,该反应的化学方程式为
(3)酸浸的目的为
(4)从浸出液得到Cu的方法为
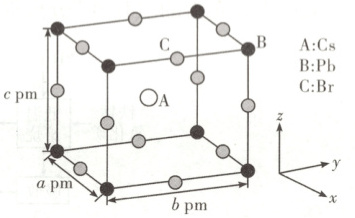
(5)某含Pb化合物是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,晶胞参数a≠b≠c,α=β=γ=90°。Cs与Pb之间的距离为

已知:As₂O₃熔点314℃,沸点460℃
分解温度:CuO 1100℃,CuSO₄ 560℃,ZnSO₄ 680℃,PbSO₄高于1000℃
Kₛₚ(PbSO₄)=1.8×10⁻⁸
(1)设计焙烧温度为600℃,理由为
使${CuSO_{4}}$分解,${ZnSO_{4}}$和${PbSO_{4}}$不分解,同时使${As_{2}O_{3}}$沸腾分离
。(2)将SO₂通入Na₂CO₃和Na₂S的混合溶液可制得Na₂S₂O₃,该反应的化学方程式为
${4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S=3Na_{2}S_{2}O_{3} + CO_{2}}$
。(3)酸浸的目的为
使${CuO}$溶解,分离${PbSO_{4}}$,得到纯净的${CuSO_{4}}$溶液
。(4)从浸出液得到Cu的方法为
用惰性电极电解浸出液,在阴极析出${Cu}$或加入过量铁粉,再加入过量盐酸,过滤(答案合理即可)
(任写一种)。
(5)某含Pb化合物是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,晶胞参数a≠b≠c,α=β=γ=90°。Cs与Pb之间的距离为
$\dfrac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}$
pm(用带有晶胞参数的代数式表示);该化合物的化学式为${CsPbBr_{3}}$
,晶体密度计算式为$\dfrac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}× abc× 10^{-30}}$
g·cm⁻³(用带有阿伏加德罗常数Nₐ的代数式表示,M₍₎、Mₚ₆和M₈ₑ分别表示Cs、Pb和Br的摩尔质量)。
答案:
4. 参考答案
(1)使${CuSO_{4}}$分解,${ZnSO_{4}}$和${PbSO_{4}}$不分解,同时使${As_{2}O_{3}}$沸腾分离
(2)${4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S=3Na_{2}S_{2}O_{3} + CO_{2}}$
(3)使${CuO}$溶解,分离${PbSO_{4}}$,得到纯净的${CuSO_{4}}$溶液
(4)用惰性电极电解浸出液,在阴极析出${Cu}$或加入过量铁粉,再加入过量盐酸,过滤(答案合理即可)
(5)$\dfrac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}$ $\dfrac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}× abc× 10^{-30}}$
命题意图本题以从铜冶炼烟尘中高效回收砷、铜、锌和铅的绿色工艺为情境,涉及化学方程式的书写、流程分析、晶胞计算等知识,综合考查考生的分析推理能力,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路铜冶炼烟尘(主要含${S}$、${As_{2}O_{3}}$及${Cu}$、${Zn}$、${Pb}$的硫酸盐)在$600\ ^{\circ}C$下焙烧,将${S}$转化为${SO_{2}}$,${As_{2}O_{3}}$因沸点低被蒸出而分离,根据已知信息,${CuSO_{4}}$在此温度下发生分解,生成${CuO}$和${SO_{3}}$,${ZnSO_{4}}$和${PbSO_{4}}$未分解,加水浸取后,${ZnSO_{4}}$溶于水形成溶液被分离出去。经酸浸,${PbSO_{4}}$不溶于硫酸,${CuO}$与硫酸反应转化成${CuSO_{4}}$,过滤分离,浸出渣为${PbSO_{4}}$,浸出液中溶质含${CuSO_{4}}$,${CuSO_{4}}$经过电解或置换法转化为铜。
(2)将${SO_{2}}$通入${Na_{2}CO_{3}}$和${Na_{2}S}$的混合溶液可发生归中反应制得${Na_{2}S_{2}O_{3}}$,根据元素守恒可知还生成了${CO_{2}}$。
(5)由该含${Pb}$化合物的晶胞图可知,${Cs}$位于体心,个数为1;${Pb}$位于顶点,个数为$8× \dfrac{1}{8}=1$;${Br}$位于棱心,个数为$12× \dfrac{1}{4}=3$。该化合物的化学式为${CsPbBr_{3}}$。${Cs}$位于体心,${Pb}$位于顶点,${Cs}$与${Pb}$之间的距离为体对角线的一半,由于晶胞参数$a\neq b\neq c$,$\alpha = \beta = \gamma = 90^{\circ}$,${Cs}$与${Pb}$之间的距离为$\dfrac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}\ {pm}$,该晶体密度计算式为$\dfrac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}× abc× 10^{-30}}\ {g· cm^{-3}}$。
(1)使${CuSO_{4}}$分解,${ZnSO_{4}}$和${PbSO_{4}}$不分解,同时使${As_{2}O_{3}}$沸腾分离
(2)${4SO_{2} + Na_{2}CO_{3} + 2Na_{2}S=3Na_{2}S_{2}O_{3} + CO_{2}}$
(3)使${CuO}$溶解,分离${PbSO_{4}}$,得到纯净的${CuSO_{4}}$溶液
(4)用惰性电极电解浸出液,在阴极析出${Cu}$或加入过量铁粉,再加入过量盐酸,过滤(答案合理即可)
(5)$\dfrac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}$ $\dfrac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}× abc× 10^{-30}}$
命题意图本题以从铜冶炼烟尘中高效回收砷、铜、锌和铅的绿色工艺为情境,涉及化学方程式的书写、流程分析、晶胞计算等知识,综合考查考生的分析推理能力,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路铜冶炼烟尘(主要含${S}$、${As_{2}O_{3}}$及${Cu}$、${Zn}$、${Pb}$的硫酸盐)在$600\ ^{\circ}C$下焙烧,将${S}$转化为${SO_{2}}$,${As_{2}O_{3}}$因沸点低被蒸出而分离,根据已知信息,${CuSO_{4}}$在此温度下发生分解,生成${CuO}$和${SO_{3}}$,${ZnSO_{4}}$和${PbSO_{4}}$未分解,加水浸取后,${ZnSO_{4}}$溶于水形成溶液被分离出去。经酸浸,${PbSO_{4}}$不溶于硫酸,${CuO}$与硫酸反应转化成${CuSO_{4}}$,过滤分离,浸出渣为${PbSO_{4}}$,浸出液中溶质含${CuSO_{4}}$,${CuSO_{4}}$经过电解或置换法转化为铜。
(2)将${SO_{2}}$通入${Na_{2}CO_{3}}$和${Na_{2}S}$的混合溶液可发生归中反应制得${Na_{2}S_{2}O_{3}}$,根据元素守恒可知还生成了${CO_{2}}$。
(5)由该含${Pb}$化合物的晶胞图可知,${Cs}$位于体心,个数为1;${Pb}$位于顶点,个数为$8× \dfrac{1}{8}=1$;${Br}$位于棱心,个数为$12× \dfrac{1}{4}=3$。该化合物的化学式为${CsPbBr_{3}}$。${Cs}$位于体心,${Pb}$位于顶点,${Cs}$与${Pb}$之间的距离为体对角线的一半,由于晶胞参数$a\neq b\neq c$,$\alpha = \beta = \gamma = 90^{\circ}$,${Cs}$与${Pb}$之间的距离为$\dfrac{\sqrt{a^{2} + b^{2} + c^{2}}}{2}\ {pm}$,该晶体密度计算式为$\dfrac{M_{Cs} + M_{Pb} + 3M_{Br}}{N_{A}× abc× 10^{-30}}\ {g· cm^{-3}}$。
5. [2024·江西卷,15T,14分]稀土是国家的战略资源之一。以下是一种以独居石[主要成分为CePO₄,含有Th₃(PO₄)₄、U₃O₈和少量镭杂质]为原料制备CeCl₃·nH₂O的工艺流程图。
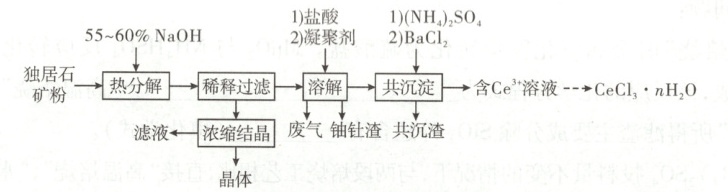
已知:ⅰ.Kₛₚ[Th(OH)₄]=4.0×10⁻⁴⁵,Kₛₚ[Ce(OH)₃]=1.6×10⁻²⁰,Kₛₚ[Ce(OH)₄]=2.0×10⁻⁴⁸
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
a.降低压强,分解速率增大
b.降低温度,分解速率降低
c.反应时间越长,分解速率越大
d.提高搅拌速度,分解速率降低
(2)Na₂U₂O₇中铀元素的化合价为
(3)浓缩结晶后,得到的晶体产物化学式为
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)₄的离子方程式为
②当溶液pH=4.5时,c(Th⁴⁺)=
(5)以BaSO₄为载体形成共沉淀,目的是去除杂质

已知:ⅰ.Kₛₚ[Th(OH)₄]=4.0×10⁻⁴⁵,Kₛₚ[Ce(OH)₃]=1.6×10⁻²⁰,Kₛₚ[Ce(OH)₄]=2.0×10⁻⁴⁸
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
b
(填标号)。a.降低压强,分解速率增大
b.降低温度,分解速率降低
c.反应时间越长,分解速率越大
d.提高搅拌速度,分解速率降低
(2)Na₂U₂O₇中铀元素的化合价为
+6
,热分解阶段U₃O₈生成Na₂U₂O₇的化学反应方程式为${2U_{3}O_{8} + O_{2} + 6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O}$
。(3)浓缩结晶后,得到的晶体产物化学式为
${Na_{3}PO_{4}· nH_{2}O}$
,滤液可用于热分解
阶段循环利用,避免产生大量的高碱度废水。(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)₄的离子方程式为
${2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}=2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O}$
。②当溶液pH=4.5时,c(Th⁴⁺)=
$4.0× 10^{-7}$
mol·L⁻¹,此时完全转化为氢氧化钍沉淀。(5)以BaSO₄为载体形成共沉淀,目的是去除杂质
${RaSO_{4}}$
。
答案:
5. 参考答案
(1)${b}$
(2)$+6$ ${2U_{3}O_{8} + O_{2} + 6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O}$
(3)${Na_{3}PO_{4}· nH_{2}O}$ 热分解
(4)①${2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}=2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O}$ ②$4.0× 10^{-7}$
(5)${RaSO_{4}}$
命题意图本题以独居石制备${CeCl_{3}· nH_{2}O}$的工艺流程为素材,涉及影响反应速率的因素、化学方程式书写、离子浓度计算等知识,体现了“宏观辨识与微观探析”“变化观念与平衡思想”化学学科核心素养。
解题思路
(1)根据
(2)生成${Na_{2}U_{2}O_{7}}$的反应可知,有${O_{2}}$参与热分解,故降低压强,氧气浓度减小,分解速率降低,${a}$项错误。降低温度,分解速率降低,${b}$项正确。反应时间越长,分解速率逐渐变慢,${c}$项错误。提高搅拌速度,反应物接触更充分,分解速率加快,${d}$项错误。
(2)${Na_{2}U_{2}O_{7}}$中${Na}$为$+1$价,${O}$为$-2$价,根据化合价代数和为0,则铀元素的化合价为$+6$,热分解阶段${U_{3}O_{8}}$生成${Na_{2}U_{2}O_{7}}$,${U}$元素化合价升高,则${O}$元素化合价降低,反应的化学方程式为${2U_{3}O_{8} + O_{2} + 6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O}$。
(3)稀释过滤后的滤液中含有${Na^{+}}$、${PO^{3-}_{4}}$,滤液浓缩结晶后,得到的晶体产物化学式为${Na_{3}PO_{4}· nH_{2}O}$。浓缩结晶后的滤液中含${Na^{+}}$、${OH^{-}}$,可用于热分解阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液${pH}$先调到$1.5\sim 2.0$,反应后再回调至$4.5$。①在热分解过程中${Ce}$的化合价由$+3$变成了$+4$,而最终生成物中${Ce}$的化合价为$+3$,说明在溶解阶段中${Ce}$的化合价又由$+4$变回了$+3$,${Ce}$元素化合价降低,在与盐酸反应中,${Cl}$元素的化合价应升高,盐酸溶解${Ce(OH)_{4}}$的离子方程式为${2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}=2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O}$。②当溶液${pH}=4.5$时,$c{(H^{+})}=1× 10^{-4.5}\ {mol· L^{-1}}$,$c{(OH^{-})}=1× 10^{-9.5}\ {mol· L^{-1}}$,$c{(Th^{4+})}× c^{4}{(OH^{-})}=K_{sp}{[Th(OH)_{4}]}=4.0× 10^{-45}$,则$c{(Th^{4+})}=4× 10^{-7}\ {mol· L^{-1}}$,此时完全转化为氢氧化钍沉淀。
(5)以${BaSO_{4}}$为载体形成共沉淀,目的是去除杂质${RaSO_{4}}$,${Ra}$和${Ba}$均为第Ⅱ${A}$族元素,则${RaSO_{4}}$也为沉淀。
(1)${b}$
(2)$+6$ ${2U_{3}O_{8} + O_{2} + 6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O}$
(3)${Na_{3}PO_{4}· nH_{2}O}$ 热分解
(4)①${2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}=2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O}$ ②$4.0× 10^{-7}$
(5)${RaSO_{4}}$
命题意图本题以独居石制备${CeCl_{3}· nH_{2}O}$的工艺流程为素材,涉及影响反应速率的因素、化学方程式书写、离子浓度计算等知识,体现了“宏观辨识与微观探析”“变化观念与平衡思想”化学学科核心素养。
解题思路
(1)根据
(2)生成${Na_{2}U_{2}O_{7}}$的反应可知,有${O_{2}}$参与热分解,故降低压强,氧气浓度减小,分解速率降低,${a}$项错误。降低温度,分解速率降低,${b}$项正确。反应时间越长,分解速率逐渐变慢,${c}$项错误。提高搅拌速度,反应物接触更充分,分解速率加快,${d}$项错误。
(2)${Na_{2}U_{2}O_{7}}$中${Na}$为$+1$价,${O}$为$-2$价,根据化合价代数和为0,则铀元素的化合价为$+6$,热分解阶段${U_{3}O_{8}}$生成${Na_{2}U_{2}O_{7}}$,${U}$元素化合价升高,则${O}$元素化合价降低,反应的化学方程式为${2U_{3}O_{8} + O_{2} + 6NaOH\xlongequal{\triangle}3Na_{2}U_{2}O_{7} + 3H_{2}O}$。
(3)稀释过滤后的滤液中含有${Na^{+}}$、${PO^{3-}_{4}}$,滤液浓缩结晶后,得到的晶体产物化学式为${Na_{3}PO_{4}· nH_{2}O}$。浓缩结晶后的滤液中含${Na^{+}}$、${OH^{-}}$,可用于热分解阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液${pH}$先调到$1.5\sim 2.0$,反应后再回调至$4.5$。①在热分解过程中${Ce}$的化合价由$+3$变成了$+4$,而最终生成物中${Ce}$的化合价为$+3$,说明在溶解阶段中${Ce}$的化合价又由$+4$变回了$+3$,${Ce}$元素化合价降低,在与盐酸反应中,${Cl}$元素的化合价应升高,盐酸溶解${Ce(OH)_{4}}$的离子方程式为${2Ce(OH)_{4} + 8H^{+} + 2Cl^{-}=2Ce^{3+} + Cl_{2}\uparrow + 8H_{2}O}$。②当溶液${pH}=4.5$时,$c{(H^{+})}=1× 10^{-4.5}\ {mol· L^{-1}}$,$c{(OH^{-})}=1× 10^{-9.5}\ {mol· L^{-1}}$,$c{(Th^{4+})}× c^{4}{(OH^{-})}=K_{sp}{[Th(OH)_{4}]}=4.0× 10^{-45}$,则$c{(Th^{4+})}=4× 10^{-7}\ {mol· L^{-1}}$,此时完全转化为氢氧化钍沉淀。
(5)以${BaSO_{4}}$为载体形成共沉淀,目的是去除杂质${RaSO_{4}}$,${Ra}$和${Ba}$均为第Ⅱ${A}$族元素,则${RaSO_{4}}$也为沉淀。
查看更多完整答案,请扫码查看


