2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. [2025·浙江1 月卷,1T,3 分]下列属于极性分子的是(
A.HCl
B.N₂
C.He
D.CH₄
A
)A.HCl
B.N₂
C.He
D.CH₄
答案:
1.参考答案A
命题意图本题考查分子极性的判断,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路HCl是由极性键形成的双原子分子,正电中心和负电中心不重合,属于极性分子,A项符合题意。N₂是非极性键形成的单质分子,正电中心和负电中心重合,属于非极性分子,B项不符合题意。He是单原子分子,正电中心和负电中心重合,属于非极性分子,C项不符合题意。CH₄是由极性键形成的正四面体结构,正电中心和负电中心重合,属于非极性分子,D项不符合题意。
命题意图本题考查分子极性的判断,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路HCl是由极性键形成的双原子分子,正电中心和负电中心不重合,属于极性分子,A项符合题意。N₂是非极性键形成的单质分子,正电中心和负电中心重合,属于非极性分子,B项不符合题意。He是单原子分子,正电中心和负电中心重合,属于非极性分子,C项不符合题意。CH₄是由极性键形成的正四面体结构,正电中心和负电中心重合,属于非极性分子,D项不符合题意。
2. [2025·安徽卷,5T,3 分]氟气通过碎冰表面,发生反应①F₂ + H₂O $\xlongequal{-40^{\circ}C}$ HOF + HF,生成的 HOF 遇水发生反应②HOF + H₂O $\xlongequal{}$ HF + H₂O₂。下列说法正确的是(
A.HOF 的电子式为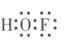
B.H₂O₂ 为非极性分子
C.反应①中有非极性键的断裂和形成
D.反应②中 HF 为还原产物
A
)A.HOF 的电子式为
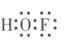
B.H₂O₂ 为非极性分子
C.反应①中有非极性键的断裂和形成
D.反应②中 HF 为还原产物
答案:
2.参考答案A
命题意图本题以氟气与H₂O的反应为情境,考查电子式、分子极性、化学键及氧化还原反应等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路HOF中心原子为O,与H、F通过共用电子对形成共价键,其电子式为${H\colon \overset{..}{O}\colon \overset{..}{F}\colon }$,A项正确。H₂O₂空间结构如图所示 ,其正、负电荷中心不重合,属于极性分子,B项错误。反应①有F—F非极性键断裂,没有非极性键的形成,C项错误。F的电负性大于O,HOF中氟为-1价,O为0价,H为+1价,故在反应②中,H、F的化合价均没有变化,O发生归中反应,故HF既不是氧化产物也不是还原产物,D项错误。
,其正、负电荷中心不重合,属于极性分子,B项错误。反应①有F—F非极性键断裂,没有非极性键的形成,C项错误。F的电负性大于O,HOF中氟为-1价,O为0价,H为+1价,故在反应②中,H、F的化合价均没有变化,O发生归中反应,故HF既不是氧化产物也不是还原产物,D项错误。
2.参考答案A
命题意图本题以氟气与H₂O的反应为情境,考查电子式、分子极性、化学键及氧化还原反应等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路HOF中心原子为O,与H、F通过共用电子对形成共价键,其电子式为${H\colon \overset{..}{O}\colon \overset{..}{F}\colon }$,A项正确。H₂O₂空间结构如图所示
 ,其正、负电荷中心不重合,属于极性分子,B项错误。反应①有F—F非极性键断裂,没有非极性键的形成,C项错误。F的电负性大于O,HOF中氟为-1价,O为0价,H为+1价,故在反应②中,H、F的化合价均没有变化,O发生归中反应,故HF既不是氧化产物也不是还原产物,D项错误。
,其正、负电荷中心不重合,属于极性分子,B项错误。反应①有F—F非极性键断裂,没有非极性键的形成,C项错误。F的电负性大于O,HOF中氟为-1价,O为0价,H为+1价,故在反应②中,H、F的化合价均没有变化,O发生归中反应,故HF既不是氧化产物也不是还原产物,D项错误。 3. [2025·安徽卷,7T,3 分]下列有关物质结构或性质的比较中,正确的是(
A.与 H⁺结合的能力:OH⁻ > NH₂⁻
B.与氨形成配位键的能力:H⁺ > Cu²⁺
C.H₂O 和 NH₃ 分子中的键长:O—H > N—H
D.微粒所含电子数:NH₄⁺ > NH₂⁻
B
)A.与 H⁺结合的能力:OH⁻ > NH₂⁻
B.与氨形成配位键的能力:H⁺ > Cu²⁺
C.H₂O 和 NH₃ 分子中的键长:O—H > N—H
D.微粒所含电子数:NH₄⁺ > NH₂⁻
答案:
3.参考答案B
命题意图本题通过微粒性质比较,考查配位能力、键长、电子数等微粒结构知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路由题意可知,NaNH₂遇水发生的反应为${NaNH_{2} + H_{2}O = NaOH + NH_{3}\uparrow}$,说明${NH^{-}_{2}}$结合${H^{+}}$能力更强,A项错误。由题意可知,深蓝色${[Cu(NH_{3})_{4}](OH)_{2}}$溶液,加入稀硫酸又转化为蓝色${[Cu(H_{2}O)_{4}]SO_{4}}$溶液,同时生成${NH^{+}_{4}}$,说明${NH_{3}}$更容易与${H^{+}}$配位形成${NH^{+}_{4}}$,故与氨形成配位键的能力${H^{+} > Cu^{2+}}$,B项正确。原子半径${N > O}$,则键长${O - H < N - H}$,C项错误。${NH^{+}_{4}}$所含电子数为$7 + 4 - 1 = 10$,${NH^{-}_{2}}$所含电子数为$7 + 2 + 1 = 10$,两种微粒所含电子数相等,D项错误。
命题意图本题通过微粒性质比较,考查配位能力、键长、电子数等微粒结构知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路由题意可知,NaNH₂遇水发生的反应为${NaNH_{2} + H_{2}O = NaOH + NH_{3}\uparrow}$,说明${NH^{-}_{2}}$结合${H^{+}}$能力更强,A项错误。由题意可知,深蓝色${[Cu(NH_{3})_{4}](OH)_{2}}$溶液,加入稀硫酸又转化为蓝色${[Cu(H_{2}O)_{4}]SO_{4}}$溶液,同时生成${NH^{+}_{4}}$,说明${NH_{3}}$更容易与${H^{+}}$配位形成${NH^{+}_{4}}$,故与氨形成配位键的能力${H^{+} > Cu^{2+}}$,B项正确。原子半径${N > O}$,则键长${O - H < N - H}$,C项错误。${NH^{+}_{4}}$所含电子数为$7 + 4 - 1 = 10$,${NH^{-}_{2}}$所含电子数为$7 + 2 + 1 = 10$,两种微粒所含电子数相等,D项错误。
4. [2025·辽宁卷,3T,3 分]Cl₂O 可用于水的杀菌消毒,遇水发生反应:Cl₂O + H₂O $\xlongequal{}$ 2HClO。下列说法正确的是(
A.反应中各分子的 σ 键均为 p - p σ 键
B.反应中各分子的 VSEPR 模型均为四面体形
C.Cl—O 键长小于 H—O 键长
D.HClO 分子中 Cl 的价电子层有 2 个孤电子对
B
)A.反应中各分子的 σ 键均为 p - p σ 键
B.反应中各分子的 VSEPR 模型均为四面体形
C.Cl—O 键长小于 H—O 键长
D.HClO 分子中 Cl 的价电子层有 2 个孤电子对
答案:
4.参考答案B
命题意图本题以Cl₂O杀菌消毒为情境,考查分子的结构与性质,意在考查考生对物质结构与性质的掌握情况,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路反应中各分子的σ键不全是p-p σ键。如H₂O、HClO中的H—O键均是s-p σ键,A项错误。Cl₂O中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形;H₂O中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形;HClO中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形,B项正确。Cl的原子半径大于H,则Cl—O键长应大于H—O键长,C项错误。HClO中Cl的最外层电子数为7,其3p轨道上的1个价电子与O形成共价键,剩余6个价电子形成3个孤电子对,D项错误。
命题意图本题以Cl₂O杀菌消毒为情境,考查分子的结构与性质,意在考查考生对物质结构与性质的掌握情况,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路反应中各分子的σ键不全是p-p σ键。如H₂O、HClO中的H—O键均是s-p σ键,A项错误。Cl₂O中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形;H₂O中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形;HClO中心O原子的价层电子对数为$2 + \frac{1}{2} × (6 - 2 × 1) = 4$,其VSEPR模型为四面体形,B项正确。Cl的原子半径大于H,则Cl—O键长应大于H—O键长,C项错误。HClO中Cl的最外层电子数为7,其3p轨道上的1个价电子与O形成共价键,剩余6个价电子形成3个孤电子对,D项错误。
5. [2025·江苏卷,4T,3 分]在溶有 15 - 冠 - 5( )的有机溶剂中,苄氯(
)的有机溶剂中,苄氯( )与 NaF 发生反应:
)与 NaF 发生反应:
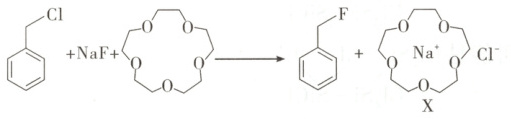
下列说法正确的是(
A.苄氯是非极性分子
B.电负性:χ(F) < χ(Cl)
C.离子半径:r(F⁻) > r(Na⁺)
D.X 中 15 - 冠 - 5 与 Na⁺间存在离子键
 )的有机溶剂中,苄氯(
)的有机溶剂中,苄氯( )与 NaF 发生反应:
)与 NaF 发生反应:
下列说法正确的是(
C
)A.苄氯是非极性分子
B.电负性:χ(F) < χ(Cl)
C.离子半径:r(F⁻) > r(Na⁺)
D.X 中 15 - 冠 - 5 与 Na⁺间存在离子键
答案:
5.参考答案C
命题意图本题结合超分子催化反应,考查分子极性、电负性、离子半径、超分子中的相互作用等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路苄氯分子含有饱和碳原子,且饱和碳原子连有三种不同的原子或原子团,分子空间结构不对称,正负电荷中心不重合,故苄氯为极性分子,A项错误。同主族元素从上到下电负性逐渐减小,故电负性${\chi (F) > \chi (Cl)}$,B项错误。${F^{-}}$和${Na^{+}}$的核外电子排布相同,核外电子排布相同时,离子半径随核电荷数增大而减小,故离子半径${\mathit{r}(F^{-}) > \mathit{r}(Na^{+})}$,C项正确。15-冠-5是分子,与${Na^{+}}$之间不存在离子键,二者通过分子间相互作用形成超分子,D项错误。
学习拓展
超分子内部“分子”通过非共价键相结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
命题意图本题结合超分子催化反应,考查分子极性、电负性、离子半径、超分子中的相互作用等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路苄氯分子含有饱和碳原子,且饱和碳原子连有三种不同的原子或原子团,分子空间结构不对称,正负电荷中心不重合,故苄氯为极性分子,A项错误。同主族元素从上到下电负性逐渐减小,故电负性${\chi (F) > \chi (Cl)}$,B项错误。${F^{-}}$和${Na^{+}}$的核外电子排布相同,核外电子排布相同时,离子半径随核电荷数增大而减小,故离子半径${\mathit{r}(F^{-}) > \mathit{r}(Na^{+})}$,C项正确。15-冠-5是分子,与${Na^{+}}$之间不存在离子键,二者通过分子间相互作用形成超分子,D项错误。
学习拓展
超分子内部“分子”通过非共价键相结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
查看更多完整答案,请扫码查看


