2026年新高考5年真题化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6.下列说法正确的是 (
A.CH4的价层电子对互斥模型和空间构型均为正四面体
B.若AB2型分子的空间构型相同,其中心原子的杂化方式也相同
C.干冰和冰的结构表明范德华力和氢键通常都具有方向性
D.CO2和CC14都是既含σ键又含π键的非极性分子
A
)A.CH4的价层电子对互斥模型和空间构型均为正四面体
B.若AB2型分子的空间构型相同,其中心原子的杂化方式也相同
C.干冰和冰的结构表明范德华力和氢键通常都具有方向性
D.CO2和CC14都是既含σ键又含π键的非极性分子
答案:
6. 参考答案 A
命题意图 本题考查物质的结构与性质,涉及价层电子对互斥模型和空间构型的判断、原子的杂化方式、范德华力和氢键、$\sigma$键与$\pi$键、分子极性的判断等,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 甲烷分子中$ C$原子的价层电子对数为4,孤电子对数为0,甲烷的价层电子对互斥模型和空间构型均为正四面体,A项正确。$ AB_2$型分子,如$ SO_2$和$ SCl_2$,分子均为V形,但是$ SO_2$中$ S$原子采取$ sp^2$杂化,$ SCl_2$分子中$ S$原子采取$ sp^3$杂化,B项错误。干冰为分子晶体,分子间存在范德华力,不具有方向性。冰的结构中含有氢键,具有方向性,C项错误。$ CO_2$分子中含有$\sigma$键和$\pi$键,但是$ CCl_4$分子中只含有$\sigma$键,没有$\pi$键,D项错误。
命题意图 本题考查物质的结构与性质,涉及价层电子对互斥模型和空间构型的判断、原子的杂化方式、范德华力和氢键、$\sigma$键与$\pi$键、分子极性的判断等,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 甲烷分子中$ C$原子的价层电子对数为4,孤电子对数为0,甲烷的价层电子对互斥模型和空间构型均为正四面体,A项正确。$ AB_2$型分子,如$ SO_2$和$ SCl_2$,分子均为V形,但是$ SO_2$中$ S$原子采取$ sp^2$杂化,$ SCl_2$分子中$ S$原子采取$ sp^3$杂化,B项错误。干冰为分子晶体,分子间存在范德华力,不具有方向性。冰的结构中含有氢键,具有方向性,C项错误。$ CO_2$分子中含有$\sigma$键和$\pi$键,但是$ CCl_4$分子中只含有$\sigma$键,没有$\pi$键,D项错误。
7.物质的结构决定其性质。下列实例与解释不相符的是 (

选项 实例 解释
A 用He替代H2填充探空气球更安全 He的电子构型稳定,不易得失电子
B BF3与NH形成加合物[HN→BF3] BF3中的B有空轨道接受NH中N的孤电子对
C 碱金属中Li的熔点最高 碱金属中Li的价电子数最少,金属键最强
D 不存在稳定的NF5分子 N原子价层只有4个原子轨道,不能形成5个N一F键
C
)
选项 实例 解释
A 用He替代H2填充探空气球更安全 He的电子构型稳定,不易得失电子
B BF3与NH形成加合物[HN→BF3] BF3中的B有空轨道接受NH中N的孤电子对
C 碱金属中Li的熔点最高 碱金属中Li的价电子数最少,金属键最强
D 不存在稳定的NF5分子 N原子价层只有4个原子轨道,不能形成5个N一F键
答案:
7. 参考答案 C
命题意图 本题考查物质的结构与性质,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 氦气是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的$ He$填充探空气球更加安全可靠,而氢气具有可燃性,使用氢气填充探空气球存在一定的安全隐患,A项正确。三氟化硼分子中硼原子具有空轨道,能与氨分子中具有孤电子对的氮原子形成配位键,所以三氟化硼能与氨分子形成加合物$[ H_3 N\rightarrow BF_3]$,B项正确。金属键的强弱取决于价电子数和原子半径。碱金属元素的价电子数相等,$ Li$的原子半径在碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,C项错误。$ N$原子的价层只有4个原子轨道,只能形成4条共价键,由共价键的饱和性可知,氮原子不能形成5个$ N—F$键,所以不存在稳定的$ NF_5$分子,D项正确。
命题意图 本题考查物质的结构与性质,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路 氦气是一种惰性气体,不易燃烧或爆炸,因此使用电子构型稳定,不易得失电子的$ He$填充探空气球更加安全可靠,而氢气具有可燃性,使用氢气填充探空气球存在一定的安全隐患,A项正确。三氟化硼分子中硼原子具有空轨道,能与氨分子中具有孤电子对的氮原子形成配位键,所以三氟化硼能与氨分子形成加合物$[ H_3 N\rightarrow BF_3]$,B项正确。金属键的强弱取决于价电子数和原子半径。碱金属元素的价电子数相等,$ Li$的原子半径在碱金属中最小,形成的金属键最强,所以碱金属中锂的熔点最高,C项错误。$ N$原子的价层只有4个原子轨道,只能形成4条共价键,由共价键的饱和性可知,氮原子不能形成5个$ N—F$键,所以不存在稳定的$ NF_5$分子,D项正确。
8.如图所示化合物是制备某些药物的中间体,其中W、X、Y、Z、Q均为短周期元素,且原子序数依次
增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是 (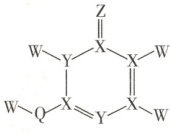
A.简单氢化物的稳定性:Z>Q
B.第一电离能:X>Y
C.基态原子的未成对电子数:X>Q
D.原子半径:Z<W
增大,分子中的所有原子均满足稀有气体的稳定电子构型,Z原子的电子数是Q的一半。下列说法正确的是 (
A
)
A.简单氢化物的稳定性:Z>Q
B.第一电离能:X>Y
C.基态原子的未成对电子数:X>Q
D.原子半径:Z<W
答案:
8. 参考答案 A
命题意图 本题考查元素推断,涉及简单氢化物的稳定性、第一电离能、基态原子的未成对电子数、原子半径等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 分子中的所有原子均满足稀有气体的稳定电子构型。根据成键规则可推出Z、Q为同一主族,Z原子的电子数是Q的一半,则Z为$ O$元素,Q为$ S$元素。由短周期元素W、X、Y、Z、Q原子序数依次增大可推知,W为$ H$元素,X为$ C$元素,Y为$ N$元素。简单氢化物的稳定性取决于元素的非金属性,非金属性$ O> S$,故简单氢化物的稳定性$ H_2 O> H_2 S$,A项正确。同一周期从左到右,元素第一电离能呈增大趋势(第ⅡA族和第ⅤA族反常),第一电离能$ C< N$,B项错误。基态$ C$原子的价层电子排布图为$\begin{array}{c}2s\\\downarrow\uparrow\end{array}\ \begin{array}{c}2p\\\uparrow\ \uparrow\ \ \end{array}$,未成对电子数为2,基态$ S$原子的价层电子排布图为$\begin{array}{c}3s\\\downarrow\uparrow\end{array}\ \begin{array}{c}3p\\\downarrow\uparrow\ \uparrow\ \uparrow\end{array}$,未成对电子数为2,C项错误。氢原子是元素周期表主族元素中半径最小的,原子半径$ O> H$,D项错误。
命题意图 本题考查元素推断,涉及简单氢化物的稳定性、第一电离能、基态原子的未成对电子数、原子半径等知识,体现了“证据推理与模型认知”化学学科核心素养。
解题思路 分子中的所有原子均满足稀有气体的稳定电子构型。根据成键规则可推出Z、Q为同一主族,Z原子的电子数是Q的一半,则Z为$ O$元素,Q为$ S$元素。由短周期元素W、X、Y、Z、Q原子序数依次增大可推知,W为$ H$元素,X为$ C$元素,Y为$ N$元素。简单氢化物的稳定性取决于元素的非金属性,非金属性$ O> S$,故简单氢化物的稳定性$ H_2 O> H_2 S$,A项正确。同一周期从左到右,元素第一电离能呈增大趋势(第ⅡA族和第ⅤA族反常),第一电离能$ C< N$,B项错误。基态$ C$原子的价层电子排布图为$\begin{array}{c}2s\\\downarrow\uparrow\end{array}\ \begin{array}{c}2p\\\uparrow\ \uparrow\ \ \end{array}$,未成对电子数为2,基态$ S$原子的价层电子排布图为$\begin{array}{c}3s\\\downarrow\uparrow\end{array}\ \begin{array}{c}3p\\\downarrow\uparrow\ \uparrow\ \uparrow\end{array}$,未成对电子数为2,C项错误。氢原子是元素周期表主族元素中半径最小的,原子半径$ O> H$,D项错误。
9.由下列实验操作及现象,不能得出相应结论的是 (
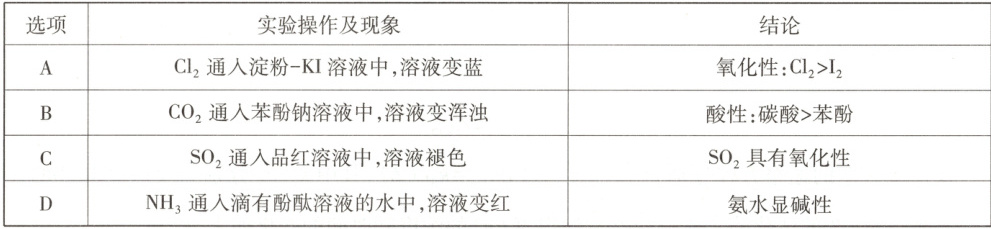
选项 实验操作及现象 结论
A Cl2通人淀粉−KI溶液中,溶液变蓝 氧化性:Cl2>I2
B CO2通人苯酚钠溶液中,溶液变浑浊 酸性:碳酸>苯酚
C SO2通入品红溶液中,溶液褪色 SO2具有氧化性
D NH3通人滴有酚酞溶液的水中,溶液变红 氨水显碱性
C
)
选项 实验操作及现象 结论
A Cl2通人淀粉−KI溶液中,溶液变蓝 氧化性:Cl2>I2
B CO2通人苯酚钠溶液中,溶液变浑浊 酸性:碳酸>苯酚
C SO2通入品红溶液中,溶液褪色 SO2具有氧化性
D NH3通人滴有酚酞溶液的水中,溶液变红 氨水显碱性
答案:
9. 参考答案 C
命题意图 本题考查实验操作、现象及结论,涉及$ Cl_2$、$ CO_2$、$ SO_2$、$ NH_3$的性质检验,意在考查考生“科学探究与创新意识”化学学科核心素养。
解题思路 $ Cl_2$和$ KI$发生反应$ Cl_2+2 KI= I_2+2 KCl$,淀粉遇碘单质变蓝色,根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性$ Cl_2> I_2$,A项正确。常温下,苯酚在水中的溶解度很小,将$ CO_2$通入苯酚钠溶液中,溶液变浑浊,说明有苯酚生成,由强酸制弱酸原理可知,酸性碳酸>苯酚,B项正确。$ SO_2$通入品红溶液中,$ SO_2$与品红溶液反应生成不稳定的无色物质,使品红溶液褪色,体现$ SO_2$的漂白性,C项错误。$ NH_3$与水反应$ NH_3+ H_2 O\rightleftharpoons NH_3· H_2 O$,$ NH_3· H_2 O$电离出$ OH^-$,使酚酞变红,氨水显碱性,D项正确。
命题意图 本题考查实验操作、现象及结论,涉及$ Cl_2$、$ CO_2$、$ SO_2$、$ NH_3$的性质检验,意在考查考生“科学探究与创新意识”化学学科核心素养。
解题思路 $ Cl_2$和$ KI$发生反应$ Cl_2+2 KI= I_2+2 KCl$,淀粉遇碘单质变蓝色,根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性$ Cl_2> I_2$,A项正确。常温下,苯酚在水中的溶解度很小,将$ CO_2$通入苯酚钠溶液中,溶液变浑浊,说明有苯酚生成,由强酸制弱酸原理可知,酸性碳酸>苯酚,B项正确。$ SO_2$通入品红溶液中,$ SO_2$与品红溶液反应生成不稳定的无色物质,使品红溶液褪色,体现$ SO_2$的漂白性,C项错误。$ NH_3$与水反应$ NH_3+ H_2 O\rightleftharpoons NH_3· H_2 O$,$ NH_3· H_2 O$电离出$ OH^-$,使酚酞变红,氨水显碱性,D项正确。
10.一种以锰尘(主要成分为Mn304,杂质为铝、镁、钙、铁的氧化物)为原料制备高纯MnC03的清洁
生产新工艺流程如图:
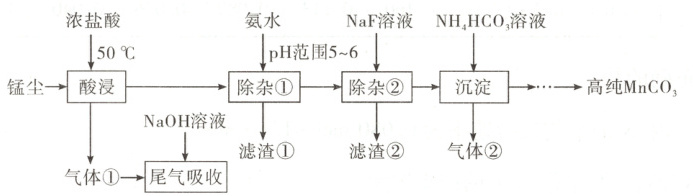
已知:室温下相关物质的K如表。

下列说法错误的是 (
A.酸浸工序中产生的气体①为氯气
B.滤渣①主要成分为Al(OH)3和Fe(OH)3
C.除杂②工序中逐渐加入NaF溶液时,若Ca2+、Mg2+浓度接近,则CaF2先析出
D.沉淀工序中发生反应的离子方程式为Mn2++2HCO3−MnCO↓+CO2↑+H20
生产新工艺流程如图:

已知:室温下相关物质的K如表。

下列说法错误的是 (
C
)A.酸浸工序中产生的气体①为氯气
B.滤渣①主要成分为Al(OH)3和Fe(OH)3
C.除杂②工序中逐渐加入NaF溶液时,若Ca2+、Mg2+浓度接近,则CaF2先析出
D.沉淀工序中发生反应的离子方程式为Mn2++2HCO3−MnCO↓+CO2↑+H20
答案:
10. 参考答案 C
命题意图 本题以制备高纯$ MnCO_3$的清洁生产新工艺流程为载体,涉及了沉淀溶解平衡等知识,考查了考生的流程推理能力与灵活应用能力,体现了“科学态度与社会责任”化学学科核心素养。
解题思路
 $ Mn_3 O_4$中含有+4价$ Mn$,与浓盐酸反应生成氯气,其余的金属氧化物均反应生成可溶氯化物,即气体①为氯气,A项正确。加入氨水调节pH为5~6,结合题目所给$K_{ sp}$可以计算$ Fe^{3+}$、$ Al^{3+}$可转化为$ Fe(OH)_3$、$ Al(OH)_3$沉淀除去,B项正确。除杂②加入$ NaF$溶液可以除去$ Ca^{2+}$和$ Mg^{2+}$,由于$ MgF_2$和$ CaF_2$结构相似,$K_{ sp}$大小为$ MgF_2< CaF_2$,所以$ Ca^{2+}$、$ Mg^{2+}$浓度接近时$ Mg^{2+}$先沉淀,C项错误。沉淀工序中,加入$ NH_4 HCO_3$溶液,$ Mn^{2+}$结合$ HCO_3^-$电离出的$ CO_3^{2-}$转化为$ MnCO_3$,剩余的$ H^+$与$ HCO_3^-$反应生成$ CO_2$和$ H_2 O$,故发生反应$ Mn^{2+}+2 HCO_3^-= MnCO_3\downarrow+ CO_2\uparrow+ H_2 O$,D项正确。
$ Mn_3 O_4$中含有+4价$ Mn$,与浓盐酸反应生成氯气,其余的金属氧化物均反应生成可溶氯化物,即气体①为氯气,A项正确。加入氨水调节pH为5~6,结合题目所给$K_{ sp}$可以计算$ Fe^{3+}$、$ Al^{3+}$可转化为$ Fe(OH)_3$、$ Al(OH)_3$沉淀除去,B项正确。除杂②加入$ NaF$溶液可以除去$ Ca^{2+}$和$ Mg^{2+}$,由于$ MgF_2$和$ CaF_2$结构相似,$K_{ sp}$大小为$ MgF_2< CaF_2$,所以$ Ca^{2+}$、$ Mg^{2+}$浓度接近时$ Mg^{2+}$先沉淀,C项错误。沉淀工序中,加入$ NH_4 HCO_3$溶液,$ Mn^{2+}$结合$ HCO_3^-$电离出的$ CO_3^{2-}$转化为$ MnCO_3$,剩余的$ H^+$与$ HCO_3^-$反应生成$ CO_2$和$ H_2 O$,故发生反应$ Mn^{2+}+2 HCO_3^-= MnCO_3\downarrow+ CO_2\uparrow+ H_2 O$,D项正确。
10. 参考答案 C
命题意图 本题以制备高纯$ MnCO_3$的清洁生产新工艺流程为载体,涉及了沉淀溶解平衡等知识,考查了考生的流程推理能力与灵活应用能力,体现了“科学态度与社会责任”化学学科核心素养。
解题思路
 $ Mn_3 O_4$中含有+4价$ Mn$,与浓盐酸反应生成氯气,其余的金属氧化物均反应生成可溶氯化物,即气体①为氯气,A项正确。加入氨水调节pH为5~6,结合题目所给$K_{ sp}$可以计算$ Fe^{3+}$、$ Al^{3+}$可转化为$ Fe(OH)_3$、$ Al(OH)_3$沉淀除去,B项正确。除杂②加入$ NaF$溶液可以除去$ Ca^{2+}$和$ Mg^{2+}$,由于$ MgF_2$和$ CaF_2$结构相似,$K_{ sp}$大小为$ MgF_2< CaF_2$,所以$ Ca^{2+}$、$ Mg^{2+}$浓度接近时$ Mg^{2+}$先沉淀,C项错误。沉淀工序中,加入$ NH_4 HCO_3$溶液,$ Mn^{2+}$结合$ HCO_3^-$电离出的$ CO_3^{2-}$转化为$ MnCO_3$,剩余的$ H^+$与$ HCO_3^-$反应生成$ CO_2$和$ H_2 O$,故发生反应$ Mn^{2+}+2 HCO_3^-= MnCO_3\downarrow+ CO_2\uparrow+ H_2 O$,D项正确。
$ Mn_3 O_4$中含有+4价$ Mn$,与浓盐酸反应生成氯气,其余的金属氧化物均反应生成可溶氯化物,即气体①为氯气,A项正确。加入氨水调节pH为5~6,结合题目所给$K_{ sp}$可以计算$ Fe^{3+}$、$ Al^{3+}$可转化为$ Fe(OH)_3$、$ Al(OH)_3$沉淀除去,B项正确。除杂②加入$ NaF$溶液可以除去$ Ca^{2+}$和$ Mg^{2+}$,由于$ MgF_2$和$ CaF_2$结构相似,$K_{ sp}$大小为$ MgF_2< CaF_2$,所以$ Ca^{2+}$、$ Mg^{2+}$浓度接近时$ Mg^{2+}$先沉淀,C项错误。沉淀工序中,加入$ NH_4 HCO_3$溶液,$ Mn^{2+}$结合$ HCO_3^-$电离出的$ CO_3^{2-}$转化为$ MnCO_3$,剩余的$ H^+$与$ HCO_3^-$反应生成$ CO_2$和$ H_2 O$,故发生反应$ Mn^{2+}+2 HCO_3^-= MnCO_3\downarrow+ CO_2\uparrow+ H_2 O$,D项正确。 查看更多完整答案,请扫码查看


