2026年天利38套中考试题分类九年级化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年天利38套中考试题分类九年级化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
22. (2025·黑龙江齐齐哈尔)现有一包固体物质,可能含有碳酸钙、碳酸钠、氯化钙、氢氧化钠、氯化铜中的一种或几种。为确定其成分,某化学小组同学进行如下探究:
步骤1:取少量该固体物质于试管中,加入足量的水,充分振荡后过滤,得到白色沉淀和无色溶液。
步骤2:向步骤1所得无色溶液中滴加酚酞溶液,溶液呈红色。再加入足量的稀盐酸,溶液红色褪去且无气泡产生。
步骤3:另取10.6g该固体物质于烧杯中,加入足量的稀盐酸,产生4.4g气体。
根据以上探究过程,下列说法中正确的是(
A.该固体物质中一定不含氯化铜
B.该固体物质最少由三种物质组成
C.该固体物质中可能含有氢氧化钠
D.若该固体物质中含有碳酸钠,则一定含有氯化钙
步骤1:取少量该固体物质于试管中,加入足量的水,充分振荡后过滤,得到白色沉淀和无色溶液。
步骤2:向步骤1所得无色溶液中滴加酚酞溶液,溶液呈红色。再加入足量的稀盐酸,溶液红色褪去且无气泡产生。
步骤3:另取10.6g该固体物质于烧杯中,加入足量的稀盐酸,产生4.4g气体。
根据以上探究过程,下列说法中正确的是(
AD
)A.该固体物质中一定不含氯化铜
B.该固体物质最少由三种物质组成
C.该固体物质中可能含有氢氧化钠
D.若该固体物质中含有碳酸钠,则一定含有氯化钙
答案:
22.AD【解析】酸碱盐的化学性质+化学方程式的有关计算
实验分析 步骤1中得到白色沉淀和无色溶液,说明固体中一定不含有氯化铜,氯化铜溶液显蓝色,若含有氯化铜,会得到蓝色溶液或者蓝色沉淀(氢氧化铜沉淀呈蓝色)[关键点]; 步骤2中溶液红色褪去且无气泡产生,说明步骤1所得的无色溶液中含有氢氧化钠,而不含有碳酸钠,从而说明原固体物质中一定含有氢氧化钠;步骤3中碳酸钙、碳酸钠与盐酸反应时的质量关系为
$\mathrm{CaCO}_3 \sim \mathrm{CO}_2$ $\mathrm{Na}_2\mathrm{CO}_3 \sim \mathrm{CO}_2$
100 44 106 44
故要生成4.4g二氧化碳,需要10g纯净碳酸钙,或10.6g纯净碳酸钠,根据步骤2推断原固体中一定含有氢氧化钠,则原固体可能是碳酸钙与氢氧化钠的混合物,也可能是碳酸钙、碳酸钠、氯化钙、氢氧化钠的混合物,还可能是碳酸钙、氯化钙、氢氧化钠的混合物。
根据分析可知,固体物质中一定不含氯化铜,A正确;该固体物质最少由碳酸钙、氢氧化钠两种物质组成,B错误;该固体物质中一定含有氢氧化钠,C错误;若该固体物质中含有碳酸钠,则一定含有氯化钙,否则步骤2中加入足量稀盐酸后会产生气泡,D正确。
实验分析 步骤1中得到白色沉淀和无色溶液,说明固体中一定不含有氯化铜,氯化铜溶液显蓝色,若含有氯化铜,会得到蓝色溶液或者蓝色沉淀(氢氧化铜沉淀呈蓝色)[关键点]; 步骤2中溶液红色褪去且无气泡产生,说明步骤1所得的无色溶液中含有氢氧化钠,而不含有碳酸钠,从而说明原固体物质中一定含有氢氧化钠;步骤3中碳酸钙、碳酸钠与盐酸反应时的质量关系为
$\mathrm{CaCO}_3 \sim \mathrm{CO}_2$ $\mathrm{Na}_2\mathrm{CO}_3 \sim \mathrm{CO}_2$
100 44 106 44
故要生成4.4g二氧化碳,需要10g纯净碳酸钙,或10.6g纯净碳酸钠,根据步骤2推断原固体中一定含有氢氧化钠,则原固体可能是碳酸钙与氢氧化钠的混合物,也可能是碳酸钙、碳酸钠、氯化钙、氢氧化钠的混合物,还可能是碳酸钙、氯化钙、氢氧化钠的混合物。
根据分析可知,固体物质中一定不含氯化铜,A正确;该固体物质最少由碳酸钙、氢氧化钠两种物质组成,B错误;该固体物质中一定含有氢氧化钠,C错误;若该固体物质中含有碳酸钠,则一定含有氯化钙,否则步骤2中加入足量稀盐酸后会产生气泡,D正确。
23. (2025·天津,不定项)某混合物由CaCO₃和Mg(OH)₂组成,取13.7g该混合物,向其中加入200g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到无色溶液。下列说法正确的是(
A.该混合物中Mg(OH)₂的质量为5.8g
B.该混合物中钙元素与镁元素质量比为5:9
C.反应生成的CO₂质量为1.1g
D.反应后溶液中氯元素的质量分数约为6.9%
B
)A.该混合物中Mg(OH)₂的质量为5.8g
B.该混合物中钙元素与镁元素质量比为5:9
C.反应生成的CO₂质量为1.1g
D.反应后溶液中氯元素的质量分数约为6.9%
答案:
23.B【解析】质量守恒定律+化学方程式的有关计算 根据 $\mathrm{CaCO}_3$、$\mathrm{Mg(OH)}_2$ 分别与 $\mathrm{HCl}$ 反应的化学方程式可分别求出 $\mathrm{CaCO}_3$、$\mathrm{Mg(OH)}_2$、$\mathrm{CO}_2$ 的质量,根据质量守恒定律可求出 $\mathrm{Cl}$ 元素的质量。设与 $\mathrm{CaCO}_3$ 反应的 $\mathrm{HCl}$ 质量为 $x$,$\mathrm{CaCO}_3$ 质量为 $y$,生成的 $\mathrm{CO}_2$ 的质量为 $z$,
$\mathrm{CaCO}_3 + 2\mathrm{HCl} \longrightarrow \mathrm{CaCl}_2 + \mathrm{H}_2\mathrm{O} + \mathrm{CO}_2 \uparrow$
100 73 44
$y$ $x$ $z$
$\frac{100}{y} = \frac{73}{x}$ ①
$\mathrm{Mg(OH)}_2 + 2\mathrm{HCl} \longrightarrow \mathrm{MgCl}_2 + 2\mathrm{H}_2\mathrm{O}$
58 73
$13.7 \mathrm{g} - y$ $200 \mathrm{g} × 7.3\% - x$
$\frac{58}{13.7 \mathrm{g} - y} = \frac{73}{200 \mathrm{g} × 7.3\% - x}$ ②
①②联立解方程组得 $x = 3.65 \mathrm{g}$,$y = 5 \mathrm{g}$,$\mathrm{Mg(OH)}_2$ 的质量 $= 13.7 \mathrm{g} - 5 \mathrm{g} = 8.7 \mathrm{g}$,A错误;$\mathrm{CaCO}_3$ 中 $\mathrm{Ca}$ 元素质量 $= 5 \mathrm{g} × \frac{40}{100} = 2 \mathrm{g}$,$\mathrm{Mg(OH)}_2$ 中 $\mathrm{Mg}$ 元素的质量 $= 8.7 \mathrm{g} × \frac{24}{58} = 3.6 \mathrm{g}$,混合物中 $\mathrm{Ca}$ 元素与 $\mathrm{Mg}$ 元素的质量比为 $2 : 3.6 = 5 : 9$,B正确;根据 A项中 $\mathrm{CaCO}_3$ 与 $\mathrm{HCl}$ 反应的化学方程式可求出生成的 $\mathrm{CO}_2$ 质量,$\frac{100}{5 \mathrm{g}} = \frac{44}{z}$,解得 $z = 2.2 \mathrm{g}$,C错误;根据化学反应前后元素质量不变,反应后溶液中 $\mathrm{Cl}$ 元素的质量等于反应前 $\mathrm{HCl}$ 中 $\mathrm{Cl}$ 元素的质量,即 $200 \mathrm{g} × 7.3\% × \frac{35.5}{36.5} = 14.2 \mathrm{g}$,反应后溶液中 $\mathrm{Cl}$ 元素的质量分数 $= \frac{14.2 \mathrm{g}}{13.7 \mathrm{g} + 200 \mathrm{g} - 2.2 \mathrm{g}} × 100\% \approx 6.7\%$,D错误。
技巧点拨
当一定量的多种物质与一定量的同一种物质恰好完全反应时可采用解方程组的方法求出未知量。溶液中某元素的质量分数 $= \frac{某元素的质量}{溶液的质量} × 100\%$,反应后所得溶液的质量 $=$ 反应前的总质量 $-$ 生成气体的质量 $-$ 生成沉淀的质量 $-$ 不溶性杂质的质量。
$\mathrm{CaCO}_3 + 2\mathrm{HCl} \longrightarrow \mathrm{CaCl}_2 + \mathrm{H}_2\mathrm{O} + \mathrm{CO}_2 \uparrow$
100 73 44
$y$ $x$ $z$
$\frac{100}{y} = \frac{73}{x}$ ①
$\mathrm{Mg(OH)}_2 + 2\mathrm{HCl} \longrightarrow \mathrm{MgCl}_2 + 2\mathrm{H}_2\mathrm{O}$
58 73
$13.7 \mathrm{g} - y$ $200 \mathrm{g} × 7.3\% - x$
$\frac{58}{13.7 \mathrm{g} - y} = \frac{73}{200 \mathrm{g} × 7.3\% - x}$ ②
①②联立解方程组得 $x = 3.65 \mathrm{g}$,$y = 5 \mathrm{g}$,$\mathrm{Mg(OH)}_2$ 的质量 $= 13.7 \mathrm{g} - 5 \mathrm{g} = 8.7 \mathrm{g}$,A错误;$\mathrm{CaCO}_3$ 中 $\mathrm{Ca}$ 元素质量 $= 5 \mathrm{g} × \frac{40}{100} = 2 \mathrm{g}$,$\mathrm{Mg(OH)}_2$ 中 $\mathrm{Mg}$ 元素的质量 $= 8.7 \mathrm{g} × \frac{24}{58} = 3.6 \mathrm{g}$,混合物中 $\mathrm{Ca}$ 元素与 $\mathrm{Mg}$ 元素的质量比为 $2 : 3.6 = 5 : 9$,B正确;根据 A项中 $\mathrm{CaCO}_3$ 与 $\mathrm{HCl}$ 反应的化学方程式可求出生成的 $\mathrm{CO}_2$ 质量,$\frac{100}{5 \mathrm{g}} = \frac{44}{z}$,解得 $z = 2.2 \mathrm{g}$,C错误;根据化学反应前后元素质量不变,反应后溶液中 $\mathrm{Cl}$ 元素的质量等于反应前 $\mathrm{HCl}$ 中 $\mathrm{Cl}$ 元素的质量,即 $200 \mathrm{g} × 7.3\% × \frac{35.5}{36.5} = 14.2 \mathrm{g}$,反应后溶液中 $\mathrm{Cl}$ 元素的质量分数 $= \frac{14.2 \mathrm{g}}{13.7 \mathrm{g} + 200 \mathrm{g} - 2.2 \mathrm{g}} × 100\% \approx 6.7\%$,D错误。
技巧点拨
当一定量的多种物质与一定量的同一种物质恰好完全反应时可采用解方程组的方法求出未知量。溶液中某元素的质量分数 $= \frac{某元素的质量}{溶液的质量} × 100\%$,反应后所得溶液的质量 $=$ 反应前的总质量 $-$ 生成气体的质量 $-$ 生成沉淀的质量 $-$ 不溶性杂质的质量。
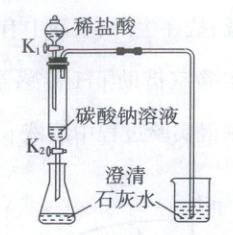
24. (2025·河南)某同学设计如图所示装置进行实验(夹持仪器略去,K₁、K₂均关闭)。打开K₁,待液体全部流下,关闭K₁,观察到烧杯中的溶液变浑浊;充分反应后,打开K₁、K₂,使液体全部流入锥形瓶,瓶中无明显现象。
(1)用化学方程式说明烧杯中的溶液变浑浊的原因。
(2)充分反应后,取锥形瓶中的溶液,测得pH=4。写出该溶液中溶质的成分。
(1)用化学方程式说明烧杯中的溶液变浑浊的原因。
(2)充分反应后,取锥形瓶中的溶液,测得pH=4。写出该溶液中溶质的成分。

答案:
(1)$\mathrm{CO}_2 + \mathrm{Ca(OH)}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + \mathrm{H}_2\mathrm{O}$
(2)氯化氢、氯化钠、氯化钙(或 $\mathrm{HCl}$、$\mathrm{NaCl}$、$\mathrm{CaCl}_2$)
【解析】常见酸碱盐的性质实验
(1)稀盐酸与碳酸钠溶液反应有二氧化碳生成,二氧化碳与烧杯中澄清石灰水反应生成碳酸钙沉淀和水,所以烧杯中的溶液变浑浊,烧杯中发生反应的化学方程式为 $\mathrm{Ca(OH)}_2 + \mathrm{CO}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + \mathrm{H}_2\mathrm{O}$。
(2)锥形瓶中的溶液 $\mathrm{pH} = 4$,呈酸性,所以溶液中一定含有 $\mathrm{HCl}$,一定没有 $\mathrm{Na}_2\mathrm{CO}_3$ 和 $\mathrm{Ca(OH)}_2$,$\mathrm{HCl}$ 与 $\mathrm{Na}_2\mathrm{CO}_3$ 反应有 $\mathrm{NaCl}$ 生成,$\mathrm{HCl}$ 与 $\mathrm{Ca(OH)}_2$ 反应有 $\mathrm{CaCl}_2$ 生成,所以该溶液中溶质是氯化氢($\mathrm{HCl}$)、氯化钠($\mathrm{NaCl}$)、氯化钙($\mathrm{CaCl}_2$)。
(1)$\mathrm{CO}_2 + \mathrm{Ca(OH)}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + \mathrm{H}_2\mathrm{O}$
(2)氯化氢、氯化钠、氯化钙(或 $\mathrm{HCl}$、$\mathrm{NaCl}$、$\mathrm{CaCl}_2$)
【解析】常见酸碱盐的性质实验
(1)稀盐酸与碳酸钠溶液反应有二氧化碳生成,二氧化碳与烧杯中澄清石灰水反应生成碳酸钙沉淀和水,所以烧杯中的溶液变浑浊,烧杯中发生反应的化学方程式为 $\mathrm{Ca(OH)}_2 + \mathrm{CO}_2 \longrightarrow \mathrm{CaCO}_3 \downarrow + \mathrm{H}_2\mathrm{O}$。
(2)锥形瓶中的溶液 $\mathrm{pH} = 4$,呈酸性,所以溶液中一定含有 $\mathrm{HCl}$,一定没有 $\mathrm{Na}_2\mathrm{CO}_3$ 和 $\mathrm{Ca(OH)}_2$,$\mathrm{HCl}$ 与 $\mathrm{Na}_2\mathrm{CO}_3$ 反应有 $\mathrm{NaCl}$ 生成,$\mathrm{HCl}$ 与 $\mathrm{Ca(OH)}_2$ 反应有 $\mathrm{CaCl}_2$ 生成,所以该溶液中溶质是氯化氢($\mathrm{HCl}$)、氯化钠($\mathrm{NaCl}$)、氯化钙($\mathrm{CaCl}_2$)。
查看更多完整答案,请扫码查看


