2026年天利38套中考试题分类九年级化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年天利38套中考试题分类九年级化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第155页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
27. (2025·福建厦门模拟)化学兴趣小组开展“海洋资源的综合利用与制盐”主题学习。
活动一:模拟海水制盐
已知自制海水的配方如表 1,相关物质的溶解度如表 2。
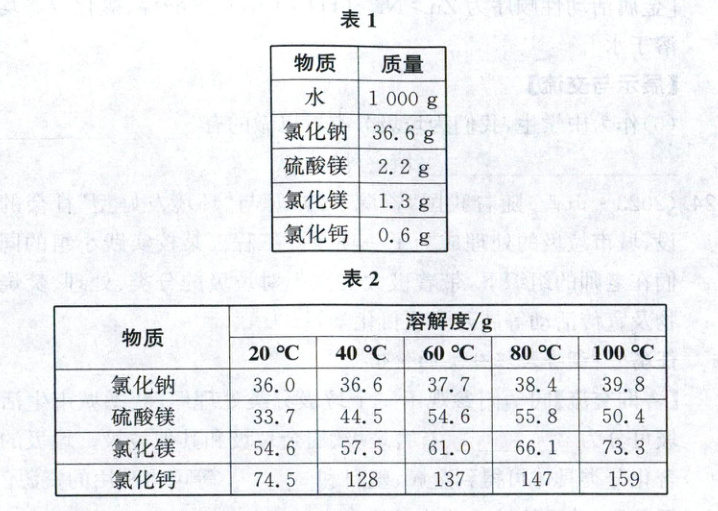
(1)根据表 1 配方配制自制海水。
①准确量取水的体积的仪器是_。
②计算自制海水中氯化钠的质量分数_(写出计算式即可)。
(2)控制在 40℃时,蒸发自制海水制盐(不考虑物质间的相互影响)。
①先析出的物质是_(写化学式)。
②恰好析出固体时,蒸发的水的质量是_g。
(3)根据表 2,分析较难用结晶法从海水中获得纯净氯化镁的原因是_。
活动二:探索海水制镁
镁被誉为“国防金属”,有广泛用途。从海水中提取镁的工业流程如图。
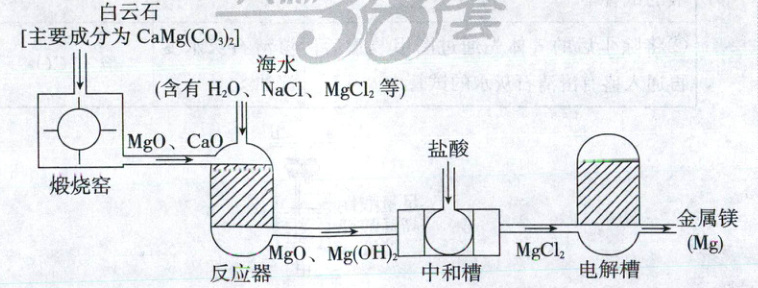
(4)“煅烧窑”中产生的气体可能是_(写一种)。
(5)“反应器”中 CaO 发生反应的化学方程式:_。
(6)“中和槽”中发生中和反应的化学方程式:_。
(7)“电解槽”中发生反应 MgCl₂\xlongequal[熔融]{通电}Mg + Cl₂↑,其基本反应类型是_。
活动一:模拟海水制盐
已知自制海水的配方如表 1,相关物质的溶解度如表 2。

(1)根据表 1 配方配制自制海水。
①准确量取水的体积的仪器是_。
②计算自制海水中氯化钠的质量分数_(写出计算式即可)。
(2)控制在 40℃时,蒸发自制海水制盐(不考虑物质间的相互影响)。
①先析出的物质是_(写化学式)。
②恰好析出固体时,蒸发的水的质量是_g。
(3)根据表 2,分析较难用结晶法从海水中获得纯净氯化镁的原因是_。
活动二:探索海水制镁
镁被誉为“国防金属”,有广泛用途。从海水中提取镁的工业流程如图。

(4)“煅烧窑”中产生的气体可能是_(写一种)。
(5)“反应器”中 CaO 发生反应的化学方程式:_。
(6)“中和槽”中发生中和反应的化学方程式:_。
(7)“电解槽”中发生反应 MgCl₂\xlongequal[熔融]{通电}Mg + Cl₂↑,其基本反应类型是_。
答案:
27.
(1)①量筒$ ②\frac{36.6\mathrm{g}}{1000\mathrm{g} + 36.6\mathrm{g} + 2.2\mathrm{g} + 1.3\mathrm{g} + 0.6\mathrm{g}} × 100\%$
$(2)①\mathrm{NaCl} ②900$
(3)溶液中溶解较多氯化钠,氯化钠溶解度比氯化镁小,氯化镁析出时氯化钠也会析出
$(4)\mathrm{CO_2}($其他合理答案也可)
$(5)\mathrm{CaO + H_2O = Ca(OH)_2}$
$(6)\mathrm{2HCl + Mg(OH)_2 = MgCl_2 + 2H_2O}$
(7)分解反应
【解析】模拟海水制盐+海水制镁
(1)①量筒可以准确量取液体体积。②溶质质量分数等于溶质质量与溶液质量之比,故自制海水中氯化钠的质量分数为$\frac{36.6\mathrm{g}}{1000\mathrm{g} + 36.6\mathrm{g} + 2.2\mathrm{g} + 1.3\mathrm{g} + 0.6\mathrm{g}} × 100\%。$
(2)①40℃时氯化钠的溶解度是36.6g,硫酸镁、氯化镁、氯化钙的溶解度都大于氯化钠,且溶液中这些物质质量很少,故最先析出的物质是$\mathrm{NaCl};$②40℃时氯化钠的溶解度是36.6g,即该温度下100g水中恰好溶解36.6g氯化钠形成饱和溶液,继续蒸发水分则氯化钠析出,故恰好析出固体时,蒸发的水的质量为1000g - 100g = 900g。
(4)不溶性的碳酸盐高温下分解生成相应的金属氧化物和碳的氧化物[关键点],故高温煅烧$\mathrm{CaMg(CO_3)_2}$生成$\mathrm{MgO}、$$\mathrm{CaO},$同时还会生成$\mathrm{CO_2}$或$\mathrm{CO}$等。
(5)“反应器”中,氧化钙和水反应生成氢氧化钙,化学方程式为$\mathrm{CaO + H_2O = Ca(OH)_2}。$
(6)中和反应是酸和碱作用生成盐和水的反应,“中和槽”中发生的中和反应是氢氧化镁和盐酸反应生成氯化镁和水,化学方程式为$\mathrm{Mg(OH)_2 + 2HCl = MgCl_2 + 2H_2O}。$
(7)该反应的特点是“一变多”,属于分解反应。
(1)①量筒$ ②\frac{36.6\mathrm{g}}{1000\mathrm{g} + 36.6\mathrm{g} + 2.2\mathrm{g} + 1.3\mathrm{g} + 0.6\mathrm{g}} × 100\%$
$(2)①\mathrm{NaCl} ②900$
(3)溶液中溶解较多氯化钠,氯化钠溶解度比氯化镁小,氯化镁析出时氯化钠也会析出
$(4)\mathrm{CO_2}($其他合理答案也可)
$(5)\mathrm{CaO + H_2O = Ca(OH)_2}$
$(6)\mathrm{2HCl + Mg(OH)_2 = MgCl_2 + 2H_2O}$
(7)分解反应
【解析】模拟海水制盐+海水制镁
(1)①量筒可以准确量取液体体积。②溶质质量分数等于溶质质量与溶液质量之比,故自制海水中氯化钠的质量分数为$\frac{36.6\mathrm{g}}{1000\mathrm{g} + 36.6\mathrm{g} + 2.2\mathrm{g} + 1.3\mathrm{g} + 0.6\mathrm{g}} × 100\%。$
(2)①40℃时氯化钠的溶解度是36.6g,硫酸镁、氯化镁、氯化钙的溶解度都大于氯化钠,且溶液中这些物质质量很少,故最先析出的物质是$\mathrm{NaCl};$②40℃时氯化钠的溶解度是36.6g,即该温度下100g水中恰好溶解36.6g氯化钠形成饱和溶液,继续蒸发水分则氯化钠析出,故恰好析出固体时,蒸发的水的质量为1000g - 100g = 900g。
(4)不溶性的碳酸盐高温下分解生成相应的金属氧化物和碳的氧化物[关键点],故高温煅烧$\mathrm{CaMg(CO_3)_2}$生成$\mathrm{MgO}、$$\mathrm{CaO},$同时还会生成$\mathrm{CO_2}$或$\mathrm{CO}$等。
(5)“反应器”中,氧化钙和水反应生成氢氧化钙,化学方程式为$\mathrm{CaO + H_2O = Ca(OH)_2}。$
(6)中和反应是酸和碱作用生成盐和水的反应,“中和槽”中发生的中和反应是氢氧化镁和盐酸反应生成氯化镁和水,化学方程式为$\mathrm{Mg(OH)_2 + 2HCl = MgCl_2 + 2H_2O}。$
(7)该反应的特点是“一变多”,属于分解反应。
查看更多完整答案,请扫码查看


