2026年天利38套中考试题分类九年级化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年天利38套中考试题分类九年级化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第202页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
5. 【新考法·作图】(2025·江苏苏州)阅读下列材料,回答相关问题。
氢气是一种清洁、高效能源。氢能产业链分制氢、储氢、用氢等环节。由风能、太阳能等可再生能源发电,再电解水制得的氢气为“绿氢”。由化石燃料制得的氢气为“灰氢”,其成本相对低廉,但会排放大量CO₂。化石燃料制氢气时若将排放的CO₂进行捕集、封存等,减少碳排放,此时制得的氢气为“蓝氢”。甲烷—水蒸气重整制氢流程如下:

化学储氢是利用物质与H₂反应生成储氢材料如氨(NH₃)、水合肼(N₂H₄·H₂O)等,再通过改变条件使储氢材料转化为H₂。氨和水合肼转化为H₂的过程分别如下:

常以质量储氢密度$\left[\frac{m(产生H_2)}{m(储氢材料)}×100\%\right]$来衡量化学储氢技术的优劣。如氨气的理论质量储氢密度为17.6%,是一种较好的储氢材料。
(1)实验室模拟电解水制氢,装置如图。

①过程中的能量转化形式:太阳能→_→化学能。该方法制得氢气的种类为_(填字母)。
A. 绿氢
B. 灰氢
C. 蓝氢
②经检验b管产生H₂,由此得出关于水的组成的推论是_。
(2)甲烷—水蒸气重整制氢。
①转化Ⅰ理论生成CO和H₂的分子个数比为_。
②写出转化Ⅱ发生反应的化学方程式:_。
(3)氨释放H₂的微观示意图如下。请在B对应框中将除氢分子外的微观粒子补充完整。
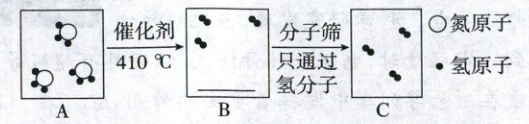
(4)①储氢材料N₂H₄·H₂O的质量储氢密度的理论值为_。
②50℃时,N₂H₄·H₂O的实际质量储氢密度小于理论值。原因是N₂H₄实际发生分解反应产生的气体中含有NH₃,写出该反应的化学方程式:_。
氢气是一种清洁、高效能源。氢能产业链分制氢、储氢、用氢等环节。由风能、太阳能等可再生能源发电,再电解水制得的氢气为“绿氢”。由化石燃料制得的氢气为“灰氢”,其成本相对低廉,但会排放大量CO₂。化石燃料制氢气时若将排放的CO₂进行捕集、封存等,减少碳排放,此时制得的氢气为“蓝氢”。甲烷—水蒸气重整制氢流程如下:

化学储氢是利用物质与H₂反应生成储氢材料如氨(NH₃)、水合肼(N₂H₄·H₂O)等,再通过改变条件使储氢材料转化为H₂。氨和水合肼转化为H₂的过程分别如下:

常以质量储氢密度$\left[\frac{m(产生H_2)}{m(储氢材料)}×100\%\right]$来衡量化学储氢技术的优劣。如氨气的理论质量储氢密度为17.6%,是一种较好的储氢材料。
(1)实验室模拟电解水制氢,装置如图。

①过程中的能量转化形式:太阳能→_→化学能。该方法制得氢气的种类为_(填字母)。
A. 绿氢
B. 灰氢
C. 蓝氢
②经检验b管产生H₂,由此得出关于水的组成的推论是_。
(2)甲烷—水蒸气重整制氢。
①转化Ⅰ理论生成CO和H₂的分子个数比为_。
②写出转化Ⅱ发生反应的化学方程式:_。
(3)氨释放H₂的微观示意图如下。请在B对应框中将除氢分子外的微观粒子补充完整。

(4)①储氢材料N₂H₄·H₂O的质量储氢密度的理论值为_。
②50℃时,N₂H₄·H₂O的实际质量储氢密度小于理论值。原因是N₂H₄实际发生分解反应产生的气体中含有NH₃,写出该反应的化学方程式:_。
答案:
(1)①电能A②水中含有氢元素
(2)①1∶3②CO+H$_2$O$\xlongequal[高温]{催化剂}$CO$_2$+H$_2$
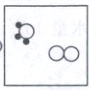
(3)
(4)①8%②3N$_2$H$_4$$\xlongequal[50^{\circ}C]{催化剂}$N$_2$+4NH$_3$
[解析]电解水实验十化学方程式的书写十化学反应的微观图示
(1)①模拟电解水制氢时是将太阳能转化成电能,电能再转化为化学能,由资料可知,该方法制得的氢气属于绿氢,故选A。②电解水时b管产生H$_2$,化学反应前后元素种类不变,由此推出水中含有氢元素。
(2)①转化I反应的化学方程式为CH$_4$+H$_2$O$\xlongequal[高温]{催化剂}$3H$_2$+CO,理论上生成CO和H$_2$的分子个数比为1∶3。②转化II发生反应的化学方程式为CO+H$_2$O$\xlongequal[高温]{催化剂}$H$_2$+CO$_2$。
(3)由反应前后原子种类和个数不变可知,图示中氨释放H$_2$时有1个NH$_3$剩余,反应除生成H$_2$外还生成N$_2$,则B中还缺少1个NH$_3$和1个N$_2$,补充图示为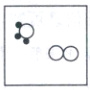
(4)①由质量储氢密度的计算公式可知,储氢材料N$_2$H$_4$·H$_2$O的质量储氢密度理论值为$\frac{4}{32+18}$×100%=8%。②由题意可知50$^{\circ}$C时N$_2$H$_4$分解产生N$_2$和NH$_3$,则反应的化学方程式为3N$_2$H$_4$$\xlongequal[50^{\circ}C]{催化剂}$N$_2$+4NH$_3$。
(1)①电能A②水中含有氢元素
(2)①1∶3②CO+H$_2$O$\xlongequal[高温]{催化剂}$CO$_2$+H$_2$
(3)

(4)①8%②3N$_2$H$_4$$\xlongequal[50^{\circ}C]{催化剂}$N$_2$+4NH$_3$
[解析]电解水实验十化学方程式的书写十化学反应的微观图示
(1)①模拟电解水制氢时是将太阳能转化成电能,电能再转化为化学能,由资料可知,该方法制得的氢气属于绿氢,故选A。②电解水时b管产生H$_2$,化学反应前后元素种类不变,由此推出水中含有氢元素。
(2)①转化I反应的化学方程式为CH$_4$+H$_2$O$\xlongequal[高温]{催化剂}$3H$_2$+CO,理论上生成CO和H$_2$的分子个数比为1∶3。②转化II发生反应的化学方程式为CO+H$_2$O$\xlongequal[高温]{催化剂}$H$_2$+CO$_2$。
(3)由反应前后原子种类和个数不变可知,图示中氨释放H$_2$时有1个NH$_3$剩余,反应除生成H$_2$外还生成N$_2$,则B中还缺少1个NH$_3$和1个N$_2$,补充图示为

(4)①由质量储氢密度的计算公式可知,储氢材料N$_2$H$_4$·H$_2$O的质量储氢密度理论值为$\frac{4}{32+18}$×100%=8%。②由题意可知50$^{\circ}$C时N$_2$H$_4$分解产生N$_2$和NH$_3$,则反应的化学方程式为3N$_2$H$_4$$\xlongequal[50^{\circ}C]{催化剂}$N$_2$+4NH$_3$。
查看更多完整答案,请扫码查看


