2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [四川达州2024高一期末]下列措施可减慢化学反应速率的是(
A.葡萄糖转化为乙醇时,加入酒化酶
B.在糕点、月饼等食品的包装袋内放置除氧剂
C.煤燃烧时,向炉膛里鼓风,并用煤粉代替煤块
D.向铁屑与稀硫酸反应的溶液中加几滴CuSO₄溶液
B
)A.葡萄糖转化为乙醇时,加入酒化酶
B.在糕点、月饼等食品的包装袋内放置除氧剂
C.煤燃烧时,向炉膛里鼓风,并用煤粉代替煤块
D.向铁屑与稀硫酸反应的溶液中加几滴CuSO₄溶液
答案:
1.B【解析】葡萄糖转化为乙醇时,酒化酶是催化剂,能够加快化学反应速率,A不符合题意;在糕点、月饼等食品的包装袋内放置除氧剂,可减小食品包装袋内O₂的浓度,从而减慢化学反应速率,B符合题意;煤燃烧时,向炉膛里鼓风可以增大氧气浓度,用煤粉代替煤块可以增大固体与气体的接触面积,均能加快化学反应速率,C不符合题意;向铁屑与稀硫酸反应的溶液中加几滴CuSO₄溶液,铁置换出的铜附着在铁上,形成原电池,从而加快化学反应速率,D不符合题意。
2. 下列措施对增大反应速率明显有效的是(
A.恒温、恒容条件下,向C(s)+H₂O(g)⇌CO(g)+H₂(g)反应体系中增加C的量
B.Fe与稀硫酸反应制取H₂时,改用浓硫酸
C.过氧化氢分解时,加入适量的MnO₂
D.合成氨反应中,在恒温、恒容条件下充入氩气使体系压强增大
C
)A.恒温、恒容条件下,向C(s)+H₂O(g)⇌CO(g)+H₂(g)反应体系中增加C的量
B.Fe与稀硫酸反应制取H₂时,改用浓硫酸
C.过氧化氢分解时,加入适量的MnO₂
D.合成氨反应中,在恒温、恒容条件下充入氩气使体系压强增大
答案:
2.C【解析】碳为固体,增加反应体系中碳的量不影响反应速率,A错误;铁与浓硫酸反应不生成氢气,且常温下铁遇浓硫酸发生钝化,阻碍了反应的进行,B错误;二氧化锰可以催化过氧化氢分解,加快反应速率,C正确;恒温、恒容条件下充入氩气使体系压强增大,但是不改变反应物的浓度,反应速率不受影响,D错误。
3. [湖北部分高中2025高一期中联考]少量铁粉与100mL0.01mol·L⁻¹的稀盐酸反应,为了加快反应速率而不改变产生H₂的量,可以使用如下方法中的(
①将铁粉换成铁块 ②加入NaNO₃固体 ③将0.01mol·L⁻¹的稀盐酸换成98%的浓硫酸 ④加入NaCl溶液 ⑤适当升高温度(不考虑盐酸挥发) ⑥改用100mL0.1mol·L⁻¹稀盐酸
A.②④
B.①③
C.⑤⑥
D.④⑤
C
)①将铁粉换成铁块 ②加入NaNO₃固体 ③将0.01mol·L⁻¹的稀盐酸换成98%的浓硫酸 ④加入NaCl溶液 ⑤适当升高温度(不考虑盐酸挥发) ⑥改用100mL0.1mol·L⁻¹稀盐酸
A.②④
B.①③
C.⑤⑥
D.④⑤
答案:
3.C【解析】①将铁粉换为铁块会导致反应物接触面积减小,反应速率会减慢,不符合题意;②加入NaNO₃固体引入了NO₃⁻,NO₃⁻在酸性条件下会被Fe还原生成氮氧化物,得不到H₂,不符合题意;③铁与浓硫酸反应不生成H₂,且常温下铁遇浓硫酸发生钝化,不符合题意;④加入NaCl溶液,H⁺浓度变小,反应速率减慢,不符合题意;⑤适当升高温度会加快反应速率,不改变生成氢气的量,符合题意;⑥改用100mL0.1mol·L⁻¹稀盐酸,氢离子的浓度增大,反应速率增大,铁少量且质量不变,生成氢气的量不变,符合题意。故选C。
4. [福建厦门2025高一月考]等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的变化情况如图,根据图示分析实验条件,下列说法中一定不正确的是(
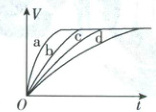

A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度可能大于2.5mol·L⁻¹
C.第2组实验中盐酸的浓度可能等于2.5mol·L⁻¹
D.第3组实验的反应温度低于30℃
D
)

A.第4组实验的反应速率最慢
B.第1组实验中盐酸的浓度可能大于2.5mol·L⁻¹
C.第2组实验中盐酸的浓度可能等于2.5mol·L⁻¹
D.第3组实验的反应温度低于30℃
答案:
4.D【解析】根据图像可知,产生相同体积气体,第4组实验所需时间最长,则第4组实验的反应速率最慢,A正确;第1、2组与第4组相比较,由于铁的状态不同(使用粉末状铁反应速率大),不能判断其盐酸的浓度是否比第4组大,因此盐酸的浓度有可能大于、等于或小于2.5mol·L⁻¹,B、C正确;采用变量控制法分析反应条件,第3、4组比较,第3组生成氢气的速率较大,所以反应温度高于30℃,D错误。
5. [江西新余2024高一期末]A与B在容积为1L的密闭容器中发生反应:aA(g)+bB(g)⇌cC(g)+dD(g),t₁、t₂min时分别测得部分数据如表:
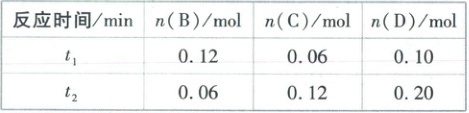
下列说法正确的是(
A.0~t₁min,平均反应速率v(B)=0.04/t₁mol·L⁻¹·min⁻¹
B.t₂min时,v(D)=0.20/t₂mol·L⁻¹·min⁻¹
C.升高温度时,v(B)、v(C)、v(D)均增大
D.b:d=5:3

下列说法正确的是(
C
)A.0~t₁min,平均反应速率v(B)=0.04/t₁mol·L⁻¹·min⁻¹
B.t₂min时,v(D)=0.20/t₂mol·L⁻¹·min⁻¹
C.升高温度时,v(B)、v(C)、v(D)均增大
D.b:d=5:3
答案:
5.C【解析】从题表中数据可以得出,t₁~t₂min,Δn(B)=0.06mol,Δn(C)=0.06mol,Δn(D)=0.10mol,b:c:d=
Δn(B):Δn(C):Δn(D)=3:3:5,则0~t₁min,Δn(B)=Δn(C)=
0.06mol,所以B的起始量为0.12mol+0.06mol=0.18mol。
0~t₁min,平均反应速率$v(B)=\frac{\frac{0.06mol}{1L}}{t₁min}=\frac{0.06}{t₁}mol·L⁻¹·min⁻¹,$A错误;0~t₂min,$v(D)=\frac{\frac{0.20mol}{1L}}{t₂min}=\frac{0.20}{t₂}mol·L⁻¹·min⁻¹,$
但此速率为0~t₂min用物质D表示的平均反应速率,而不是t₂min时用物质D表示的瞬时速率,B错误;升高温度,反应速率加快,则v(B)、v(C)、v(D)均增大,C正确;由分析可知,b:d=3:5,D错误。
Δn(B):Δn(C):Δn(D)=3:3:5,则0~t₁min,Δn(B)=Δn(C)=
0.06mol,所以B的起始量为0.12mol+0.06mol=0.18mol。
0~t₁min,平均反应速率$v(B)=\frac{\frac{0.06mol}{1L}}{t₁min}=\frac{0.06}{t₁}mol·L⁻¹·min⁻¹,$A错误;0~t₂min,$v(D)=\frac{\frac{0.20mol}{1L}}{t₂min}=\frac{0.20}{t₂}mol·L⁻¹·min⁻¹,$
但此速率为0~t₂min用物质D表示的平均反应速率,而不是t₂min时用物质D表示的瞬时速率,B错误;升高温度,反应速率加快,则v(B)、v(C)、v(D)均增大,C正确;由分析可知,b:d=3:5,D错误。
6. [河北衡水中学2025高一期中]用Na₂FeO₄溶液氧化废水中的还原性污染物M,为研究降解效果设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度与时间的关系如图所示。
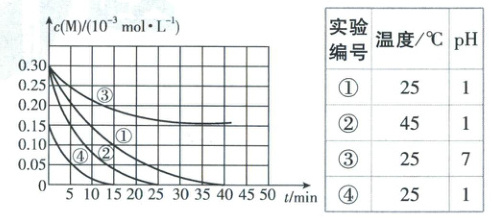
下列说法错误的是(
A.实验①,0~15min,M的降解速率约为1.33×10⁻²mol·L⁻¹·min⁻¹
B.对比实验①④说明M的浓度越小,M降解的速率越慢
C.实验①③证明pH越高,越不利于M的降解
D.对比实验①②说明温度升高,M降解速率加快

下列说法错误的是(
A
)A.实验①,0~15min,M的降解速率约为1.33×10⁻²mol·L⁻¹·min⁻¹
B.对比实验①④说明M的浓度越小,M降解的速率越慢
C.实验①③证明pH越高,越不利于M的降解
D.对比实验①②说明温度升高,M降解速率加快
答案:
6.A【解析】由图中数据,可知实验①中15min内,Δc(M)=
(0.3-0.1)×10⁻³mol·L⁻¹=2×10⁻⁴mol·L⁻¹则v(M)=
$\frac{Δc(M)}{Δt}=\frac{2×10⁻⁴mol·L⁻¹}{15min}≈1.33×10⁻⁵mol·L⁻¹·min⁻¹,$A错
误;实验①和实验④的反应温度相同、pH相同,起始浓度不同,0~15min内,实验④中M的浓度变化量小于实验①中M的浓度变化量,说明M的浓度越小,降解的速率越慢,B正
确;由图表可看出,实验①③温度相同,M的起始浓度相同,实验③的pH高,相同时间内,实验③中M的浓度大,且充分反应后,M的浓度仍大于1.5×10⁻⁴mol·L⁻¹,说明pH越高,越不利于M的降解,C正确;根据图表信息可知,实验①②的单一变量是温度,实验②的温度>实验①,从曲线看,在相同时间内,曲线②的下降幅度大于曲线①的,故温度升高,M的降解速率加快,D正确。
(0.3-0.1)×10⁻³mol·L⁻¹=2×10⁻⁴mol·L⁻¹则v(M)=
$\frac{Δc(M)}{Δt}=\frac{2×10⁻⁴mol·L⁻¹}{15min}≈1.33×10⁻⁵mol·L⁻¹·min⁻¹,$A错
误;实验①和实验④的反应温度相同、pH相同,起始浓度不同,0~15min内,实验④中M的浓度变化量小于实验①中M的浓度变化量,说明M的浓度越小,降解的速率越慢,B正
确;由图表可看出,实验①③温度相同,M的起始浓度相同,实验③的pH高,相同时间内,实验③中M的浓度大,且充分反应后,M的浓度仍大于1.5×10⁻⁴mol·L⁻¹,说明pH越高,越不利于M的降解,C正确;根据图表信息可知,实验①②的单一变量是温度,实验②的温度>实验①,从曲线看,在相同时间内,曲线②的下降幅度大于曲线①的,故温度升高,M的降解速率加快,D正确。
查看更多完整答案,请扫码查看


