2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [湖北武汉重点高中 2025 高一联考]硫元素的“价—类”二维图如图所示。下列有关叙述正确的是(

A.硫元素的性质活泼,自然界中不存在 b
B.物质 a 与 c、f、e 都有可能发生化学反应生成 b
C.将 c 通入品红溶液中,溶液红色加深后褪色
D.将 f 的水溶液在空气中放置一段时间,其 pH 将增大
B
)
A.硫元素的性质活泼,自然界中不存在 b
B.物质 a 与 c、f、e 都有可能发生化学反应生成 b
C.将 c 通入品红溶液中,溶液红色加深后褪色
D.将 f 的水溶液在空气中放置一段时间,其 pH 将增大
答案:
1.B 思路导引 根据S元素的“价—类”二维图可知,a为H₂S,b为S,c为SO₂,d为SO₃,e为H₂SO₄,f为H₂SO₃,h为硫酸盐,g为亚硫酸盐。
【解析】自然界中存在游离态的硫,主要存在于火山口附近或地壳岩层中,A错误;a(硫化氢)和c(二氧化硫)反应生成硫和水,a(硫化氢)和f(亚硫酸)反应生成硫和水,a(硫化氢)和e(浓硫酸)反应生成硫、二氧化硫和水,b为硫,因此a与c、f、e都有可能发生化学反应生成b,B正确;SO₂具有漂白性,将SO₂通人品红溶液中,品红溶液褪色,C错误;将H₂SO₃的水溶液在空气中放置一段时间,H₂SO₃具有较强还原性,易被氧气氧化为H₂SO₄,硫酸为强酸,酸性增强,pH将减小,D错误。
【解析】自然界中存在游离态的硫,主要存在于火山口附近或地壳岩层中,A错误;a(硫化氢)和c(二氧化硫)反应生成硫和水,a(硫化氢)和f(亚硫酸)反应生成硫和水,a(硫化氢)和e(浓硫酸)反应生成硫、二氧化硫和水,b为硫,因此a与c、f、e都有可能发生化学反应生成b,B正确;SO₂具有漂白性,将SO₂通人品红溶液中,品红溶液褪色,C错误;将H₂SO₃的水溶液在空气中放置一段时间,H₂SO₃具有较强还原性,易被氧气氧化为H₂SO₄,硫酸为强酸,酸性增强,pH将减小,D错误。
2. [广东广州华南师大附中 2025 高一期中联考]将一支充满 SO₂的试管倒扣入下列溶液中,现象正确且能得出相应结论的是(
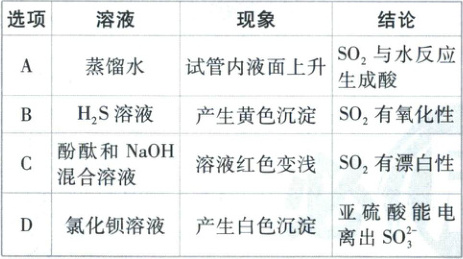
B
)
答案:
2.B 【解析】二氧化硫易溶于水,将充满SO₂的试管倒扣入蒸馏水中,试管内液面会上升,仅根据液面上升这一现象,不能得出SO₂与水反应生成酸的结论,A错误;SO₂与H₂S溶液反应的化学方程式为2H₂S+SO₂=3S↓+2H₂O,会产生黄色沉淀硫,在该反应中,SO₂中硫元素的化合价从+4降低到0,体现了SO₂的氧化性,B正确;SO₂能与NaOH溶液反应,化学方程式为SO₂+2NaOH=Na₂SO₃+H₂O,导致溶液碱性减弱,酚酞溶液红色变浅,该现象不能说明SO₂有漂白性,C错误;由于亚硫酸的酸性弱于盐酸,SO₂与氯化钡溶液不反应,不会产生白色沉淀,D错误。
3. 硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
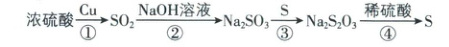
下列判断不正确的是(
A.反应①中氧化剂与还原剂的物质的量之比为 1 : 1
B.反应②表明 SO₂具有酸性氧化物的性质
C.反应③的原子利用率是 100%
D.反应④中硫酸作氧化剂
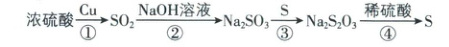
下列判断不正确的是(
D
)A.反应①中氧化剂与还原剂的物质的量之比为 1 : 1
B.反应②表明 SO₂具有酸性氧化物的性质
C.反应③的原子利用率是 100%
D.反应④中硫酸作氧化剂
答案:
3.D 【解析】反应①为浓硫酸氧化铜单质的反应,硫酸作氧化剂,被还原成SO₂,S元素由+6价降至+4价,Cu作还原剂,被氧化成Cu²⁺,Cu元素由0价升高至+2价,所以反应①中氧化剂与还原剂的物质的量之比为1:1,A正确;二氧化硫与NaOH反应生成一种盐和水,表明二氧化硫为酸性氧化物,B正确;反应③为Na₂SO₃+S=Na₂S₂O₃,生成物只有一种,原子利用率是100%,C正确;反应④的化学方程式为Na₂S₂O₃+H₂SO₄=Na₂SO₄+S↓+SO₂↑+H₂O,H₂SO₄中各元素无化合价的变化,故硫酸既不是氧化剂也不是还原剂,D错误。
4. 下列离子方程式书写正确的是(
A.往 NaHSO₄溶液中加 Ba(OH)₂溶液至中性:Ba²⁺ + 2OH⁻ + 2H⁺ + SO₄²⁻ = BaSO₄↓ + 2H₂O
B.已知酸性:H₂SO₃ > HClO,向次氯酸钙溶液中通入 SO₂:Ca²⁺ + 2ClO⁻ + SO₂ + H₂O = CaSO₃↓ + 2HClO
C.将过量的 SO₂通入饱和 NaHCO₃溶液中:2H⁺ + CO₃²⁻ = H₂O + CO₂↑
D.向 Na₂S 溶液中通入过量 SO₂:2S²⁻ + 3SO₂ = 3S↓ + 2SO₃²⁻
A
)A.往 NaHSO₄溶液中加 Ba(OH)₂溶液至中性:Ba²⁺ + 2OH⁻ + 2H⁺ + SO₄²⁻ = BaSO₄↓ + 2H₂O
B.已知酸性:H₂SO₃ > HClO,向次氯酸钙溶液中通入 SO₂:Ca²⁺ + 2ClO⁻ + SO₂ + H₂O = CaSO₃↓ + 2HClO
C.将过量的 SO₂通入饱和 NaHCO₃溶液中:2H⁺ + CO₃²⁻ = H₂O + CO₂↑
D.向 Na₂S 溶液中通入过量 SO₂:2S²⁻ + 3SO₂ = 3S↓ + 2SO₃²⁻
答案:
4.A 【解析】NaHSO₄与Ba(OH)₂反应至中性时,前者物质的量是后者的2倍,离子方程式为Ba²⁺+2OH⁻+2H⁺+SO₄²⁻=BaSO₄↓+2H₂O,A正确;次氯酸具有强氧化性,最终生成CaSO₄和Cl⁻,B错误;碳酸氢根离子为弱酸的酸式酸根离子,二氧化硫为氧化物,都不能拆,C错误;过量的二氧化硫还能够和亚硫酸根离子继续反应生成亚硫酸氢根离子,离子方程式应为2S²⁻+5SO₂+2H₂O=3S↓+4HSO₃⁻,D错误。
5. 创新装置[江西南昌二中 2025 月考]实验改进与优化应遵循科学性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是(

A.甲中使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B.乙中用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气
C.利用丙装置可制取 SO₂,并进行 SO₂性质的探究实验
D.利用丁装置可较长时间看到白色絮状沉淀
C
)
A.甲中使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B.乙中用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气
C.利用丙装置可制取 SO₂,并进行 SO₂性质的探究实验
D.利用丁装置可较长时间看到白色絮状沉淀
答案:
5.C 【解析】恒压滴液漏斗为密闭装置且能平衡压强,使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下,A正确。在煤油与水的交界面处,钠与水反应生成氢气,氢气具有可燃性,和氧气混合点燃容易爆炸;乙中用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气,B正确。铜和浓硫酸需要加热才能反应生成二氧化硫,C错误。A中生成氢气,能排净装置中空气且生成硫酸亚铁,反应一段时间后关闭a,A中压强变大,硫酸亚铁溶液被压入B中与NaOH溶液反应生成氢氧化亚铁沉淀,由于装置中空气被排净,所以利用此装置可较长时间看到白色絮状沉淀,D正确。
6. [山东济宁 2024 高一期中]工业上煅烧含硫矿物产生的 SO₂可以按如下流程脱除或利用。
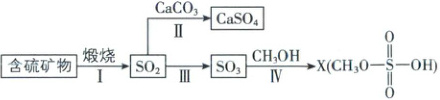
已知:途径Ⅰ、Ⅱ、Ⅲ中均有空气参与;硫酸的结构 。下列说法错误的是(
。下列说法错误的是(
A.含硫矿物粉碎有利于提高煅烧效率
B.途径Ⅱ发生的反应为 2CaCO₃ + O₂ + 2SO₂$\xlongequal{高温}$2CaSO₄ + 2CO₂
C.途径Ⅲ产生的 SO₃用 98.3%的浓硫酸吸收制得硫酸
D.流程中的含硫化合物所含 S 元素的化合价均不同

已知:途径Ⅰ、Ⅱ、Ⅲ中均有空气参与;硫酸的结构
 。下列说法错误的是(
。下列说法错误的是(D
)A.含硫矿物粉碎有利于提高煅烧效率
B.途径Ⅱ发生的反应为 2CaCO₃ + O₂ + 2SO₂$\xlongequal{高温}$2CaSO₄ + 2CO₂
C.途径Ⅲ产生的 SO₃用 98.3%的浓硫酸吸收制得硫酸
D.流程中的含硫化合物所含 S 元素的化合价均不同
答案:
6.D 【解析】含硫矿物粉碎能增大反应物间的接触面积,有利于提高煅烧效率,A正确;高温条件下,CaCO₃、O₂和SO₂反应生成CaSO₄和CO₂,反应方程式为$2CaCO₃+O₂+2SO₂\overset{高温}{=}2CaSO₄+2CO₂,$B正确;用水吸收SO₃会放出大量的热,产生酸雾,所以工业上用98.3%的浓硫酸吸收途径Ⅲ产生的SO₃得到H₂SO₄,C正确;流程中SO₃、CaSO₄与CH₃OSO₃H中S的化合价都是+6,D错误。
查看更多完整答案,请扫码查看


