2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
5. 研究表明,在一定条件下,气态HCN转化为气态CNH的能量变化如图所示。下列说法正确的是(
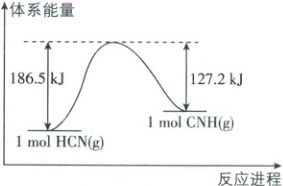
A.CNH(g)比HCN(g)更稳定
B.HCN(g)转化为CNH(g)一定要加热
C.断开1mol HCN(g)中所有的化学键需要放出127.2kJ的能量
D.1mol HCN(g)转化为1mol CNH(g)需要吸收59.3kJ的能量
D
)
A.CNH(g)比HCN(g)更稳定
B.HCN(g)转化为CNH(g)一定要加热
C.断开1mol HCN(g)中所有的化学键需要放出127.2kJ的能量
D.1mol HCN(g)转化为1mol CNH(g)需要吸收59.3kJ的能量
答案:
5.D【解析】物质的能量越低越稳定,根据题图可知,等物质的量的HCN(g)比CNH(g)的能量更低,因此HCN(g)比CNH(g)更稳定,A错误;由题图可知,HCN(g)→CNH(g)为吸热反应,但吸热反应不一定需要在加热条件下进行,B错误;根据题图可知,1molHCN(g)转化为中间状态的物质需吸收186.5kJ的能量,但由于该中间物质中可能仍然存在化学键,因此1molHCN(g)中的所有化学键全部断开需要吸收的能量大于或等于186.5kJ,C错误;根据题图可知,1molHCN(g)转化为1molCNH(g)需要吸收的能量为186.5kJ-127.2kJ=59.3kJ,D正确。
6. [河南名校联盟2025高一月考]氢能驱动未来,某汽车氢氧燃料电池的结构简图如图,下列说法错误的是(

A.储气罐b中盛装的为氧气
B.膜电极组件采用纳米材料可增大气体的吸收效率
C.左侧电极发生的反应为H₂ - 2e⁻ = 2H⁺
D.一段时间后电解质溶液中OH⁻的浓度变小
C
)
A.储气罐b中盛装的为氧气
B.膜电极组件采用纳米材料可增大气体的吸收效率
C.左侧电极发生的反应为H₂ - 2e⁻ = 2H⁺
D.一段时间后电解质溶液中OH⁻的浓度变小
答案:
6.C【解析】由题图可知,电子沿导线自左至右移动,电解质溶液中$OH^-$自右至左移动,可推测膜电极为负极,储气罐a中气体为$H_2$,MEA电极为正极,储气罐b中气体为$O_2$。储气罐b盛装的气体为氧气,A正确;纳米材料有较大的比表面积,可增大气体与膜电极接触面积,加快吸收效率,B正确;膜电极为负极,电极反应式为$H_2-2e^-+2OH^-=2H_2O$,C错误;电池总反应为$2H_2+O_2=2H_2O$,一段时间后溶剂水增多,电解质溶液浓度减小,D正确。
7. [四川眉山2024高一期中联考]科学家设计出质子膜H₂S燃料电池,实现了利用H₂S废气资源回收能量并得到单质硫。质子膜H₂S燃料电池的结构示意图如图所示。下列说法不正确的是(
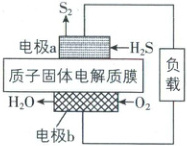
A.电流方向:电极b→负载→电极a→质子固体电解质膜→电极b
B.电极a上发生的电极反应为2H₂S - 4e⁻ = S₂ + 4H⁺
C.每34g H₂S参与反应,有2mol H⁺经质子固体电解质膜进入正极区
D.电路中每通过2mol电子,在正极消耗11.2L O₂
D
)
A.电流方向:电极b→负载→电极a→质子固体电解质膜→电极b
B.电极a上发生的电极反应为2H₂S - 4e⁻ = S₂ + 4H⁺
C.每34g H₂S参与反应,有2mol H⁺经质子固体电解质膜进入正极区
D.电路中每通过2mol电子,在正极消耗11.2L O₂
答案:
7.D
思路导引$H_2S$燃料电池中,电极a上$H_2S$失电子生成$S_2$和$H^+$,为负极,负极反应式为$2H_2S-4e^-=S_2+4H^+$;电极b为正极,正极上$O_2$得电子和氢离子反应生成$H_2O$,电极反应式为$O_2+4H^++4e^-=2H_2O$。
【解析】电流由正极流向负极,即电流方向:电极b→负载→电极a→质子固体电解质膜→电极b,A正确;根据思路导引可知,B正确;34g$H_2S$物质的量$n(H_2S)=\frac{34g}{34g·mol^{-1}}=1mol$,根据负极反应式知,每1mol$H_2S$参与反应,有2mol$H^+$经质子固体电解质膜进入正极区,C正确;正极反应式为$O_2+4H^++4e^-=2H_2O$,电路中通过2mol电子时,在正极消耗0.5mol$O_2$,未指明标准状况,无法计算氧气的体积,D错误。
思路导引$H_2S$燃料电池中,电极a上$H_2S$失电子生成$S_2$和$H^+$,为负极,负极反应式为$2H_2S-4e^-=S_2+4H^+$;电极b为正极,正极上$O_2$得电子和氢离子反应生成$H_2O$,电极反应式为$O_2+4H^++4e^-=2H_2O$。
【解析】电流由正极流向负极,即电流方向:电极b→负载→电极a→质子固体电解质膜→电极b,A正确;根据思路导引可知,B正确;34g$H_2S$物质的量$n(H_2S)=\frac{34g}{34g·mol^{-1}}=1mol$,根据负极反应式知,每1mol$H_2S$参与反应,有2mol$H^+$经质子固体电解质膜进入正极区,C正确;正极反应式为$O_2+4H^++4e^-=2H_2O$,电路中通过2mol电子时,在正极消耗0.5mol$O_2$,未指明标准状况,无法计算氧气的体积,D错误。
8. 常温下,将除去表面氧化膜的铝、铜片插入浓硝酸中组成原电池(如图甲所示),测得原电池的电流强度(I)随时间(t)的变化如图乙所示,下列说法正确的是(

A.0~t₁s,原电池的负极是铜片
B.0~t₁s,正极发生还原反应,产生氢气
C.t₁s后,电流方向发生变化的原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D.t₁s后,电子从铝片流出经过外电路流向铜片
C
)
A.0~t₁s,原电池的负极是铜片
B.0~t₁s,正极发生还原反应,产生氢气
C.t₁s后,电流方向发生变化的原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D.t₁s后,电子从铝片流出经过外电路流向铜片
答案:
8.C【解析】由题图可知,在$t_1$s前后,电路中的电流方向是相反的。$t_1$s前,因为铝比铜活泼,原电池的负极是铝片,铝发生氧化反应生成氧化铝,正极为铜;$t_1$s后,铝片表面生成的致密的氧化铝薄膜阻止了铝的进一步反应,负极变为铜片。根据上述分析可知,0~$t_1$s,原电池的负极是铝片,A错误;由分析可知,0~$t_1$s,正极为铜,正极上硝酸根离子被还原为二氧化氮,正极的电极反应式为$2H^++NO_3^-+e^-=NO_2↑+H_2O$,B错误;$t_1$s后,Cu为负极,电子从铜片流出经过外电路流向铝片,D错误。
9. [浙江嘉兴八校2025高一期中]回答下列问题:
(1)化学反应中伴随着能量变化,符合如图能量变化的化学反应是

A. 碳酸钙分解
B. 硝酸铵溶于水
C. 氧化铁与Al高温反应
(2)在一定温度和压强下,肼(N₂H₄)和O₂发生如下反应:N₂H₄(g) + O₂(g) ⇌ N₂(g) + 2H₂O(g)。已知:肼分子中氮元素为-2价;断开1mol N₂H₄和1mol O₂中的化学键需分别吸收1718kJ和500kJ热量,形成1mol N₂和1mol H₂O中的化学键需分别放出942kJ和926kJ热量。该反应属于
(3)肼(N₂H₄)还是一种良好的火箭推进剂,与助燃剂液态N₂O₄发生反应,放出大量热且对环境无污染,写出该反应的化学方程式:________________________。
(1)化学反应中伴随着能量变化,符合如图能量变化的化学反应是
A
(填序号)。
A. 碳酸钙分解
B. 硝酸铵溶于水
C. 氧化铁与Al高温反应
(2)在一定温度和压强下,肼(N₂H₄)和O₂发生如下反应:N₂H₄(g) + O₂(g) ⇌ N₂(g) + 2H₂O(g)。已知:肼分子中氮元素为-2价;断开1mol N₂H₄和1mol O₂中的化学键需分别吸收1718kJ和500kJ热量,形成1mol N₂和1mol H₂O中的化学键需分别放出942kJ和926kJ热量。该反应属于
放热
反应(填“放热”或“吸热”),1mol N₂H₄(g)和1mol O₂(g)的总能量>
(填“>”“=”或“<”)1mol N₂(g)和2mol H₂O(g)的总能量。(3)肼(N₂H₄)还是一种良好的火箭推进剂,与助燃剂液态N₂O₄发生反应,放出大量热且对环境无污染,写出该反应的化学方程式:________________________。
答案:
9.
(1)A
(2)放热>
(3)$2N_2H_4+N_2O_4\xlongequal{点燃}3N_2+4H_2O$
【解析】
(1)碳酸钙分解属于吸热反应,A符合题意;硝酸铵溶于水属于物理变化,不是化学反应,B不符合题意;氧化铁与Al发生铝热反应,属于放热反应,C不符合题意。
(2)断开1mol$N_2H_4$和1mol$O_2$中化学键吸收的热量为1718kJ+500kJ=2218kJ,形成1mol$N_2$和2mol$H_2O$中化学键放出的热量为942kJ+2×926kJ=2794kJ>2218kJ,该反应属于放热反应,即1mol$N_2H_4$(g)和1mol$O_2$(g)的总能量>1mol$N_2$(g)和2mol$H_2O$(g)的总能量。
(3)$N_2H_4$与助燃剂液态$N_2O_4$发生反应,放出大量热且对环境无污染,说明产物是氮气和水,该反应的化学方程式为$2N_2H_4+N_2O_4\xlongequal{点燃}3N_2+4H_2O$。
(1)A
(2)放热>
(3)$2N_2H_4+N_2O_4\xlongequal{点燃}3N_2+4H_2O$
【解析】
(1)碳酸钙分解属于吸热反应,A符合题意;硝酸铵溶于水属于物理变化,不是化学反应,B不符合题意;氧化铁与Al发生铝热反应,属于放热反应,C不符合题意。
(2)断开1mol$N_2H_4$和1mol$O_2$中化学键吸收的热量为1718kJ+500kJ=2218kJ,形成1mol$N_2$和2mol$H_2O$中化学键放出的热量为942kJ+2×926kJ=2794kJ>2218kJ,该反应属于放热反应,即1mol$N_2H_4$(g)和1mol$O_2$(g)的总能量>1mol$N_2$(g)和2mol$H_2O$(g)的总能量。
(3)$N_2H_4$与助燃剂液态$N_2O_4$发生反应,放出大量热且对环境无污染,说明产物是氮气和水,该反应的化学方程式为$2N_2H_4+N_2O_4\xlongequal{点燃}3N_2+4H_2O$。
查看更多完整答案,请扫码查看


