2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [四川绵阳2025高一期中]下列有关硅及其化合物的说法正确的是(
A.木材、织物浸过水玻璃后具有防腐性能且不易燃烧
B.${Si\to SiO_{2}\to H_{2}SiO_{3}\to Na_{2}SiO_{3}}$均能进行一步转化
C.陶瓷、石英玻璃、水泥、金刚砂都属于硅酸盐材料
D.用带磨口玻璃塞的试剂瓶保存${NaOH}$溶液
A
)A.木材、织物浸过水玻璃后具有防腐性能且不易燃烧
B.${Si\to SiO_{2}\to H_{2}SiO_{3}\to Na_{2}SiO_{3}}$均能进行一步转化
C.陶瓷、石英玻璃、水泥、金刚砂都属于硅酸盐材料
D.用带磨口玻璃塞的试剂瓶保存${NaOH}$溶液
答案:
1.A【解析】水玻璃是硅酸钠的水溶液,它可以在木材、织物表面形成一层保护膜,使其具有防腐性能且不易燃烧,A正确。Si可以与氧气反应生成SiO₂;二氧化硅不溶于水,不能直接与水反应生成硅酸,需要先与强碱溶液反应生成硅酸盐,再与酸反应才能生成硅酸,B错误。石英玻璃的主要成分是SiO₂,不属于硅酸盐材料,金刚砂的主要成分是碳化硅(SiC),也不属于硅酸盐材料,C错误。磨口玻璃塞中的二氧化硅会与氢氧化钠溶液反应生成具有黏性的硅酸钠,将瓶塞和试剂瓶黏结在一起,所以不能用带磨口玻璃塞的试剂瓶保存NaOH溶液,应该用橡胶塞或木塞,D错误。
2. [福建莆田二中2025高一期中]下列指定反应的离子方程式正确的是(
A.${NO_{2}}$与水反应:${2NO_{2} + H_{2}O\xlongequal{}2H^{+} + 2NO^{-}_{3}}$
B.将${SO_{2}}$通入过量冷氨水中:${SO_{2} + 2NH_{3}· H_{2}O\xlongequal{}SO^{2-}_{3} + 2NH^{+}_{4} + H_{2}O}$
C.铜与浓硝酸反应:${3Cu + 2NO^{-}_{3} + 8H^{+}\xlongequal{}3Cu^{2+} + 2NO\uparrow + 4H_{2}O}$
D.向${NH_{4}HCO_{3}}$溶液中加入过量${NaOH}$溶液并加热:${NH^{+}_{4} + OH^{-}\xlongequal{\triangle}NH_{3}\uparrow + H_{2}O}$
B
)A.${NO_{2}}$与水反应:${2NO_{2} + H_{2}O\xlongequal{}2H^{+} + 2NO^{-}_{3}}$
B.将${SO_{2}}$通入过量冷氨水中:${SO_{2} + 2NH_{3}· H_{2}O\xlongequal{}SO^{2-}_{3} + 2NH^{+}_{4} + H_{2}O}$
C.铜与浓硝酸反应:${3Cu + 2NO^{-}_{3} + 8H^{+}\xlongequal{}3Cu^{2+} + 2NO\uparrow + 4H_{2}O}$
D.向${NH_{4}HCO_{3}}$溶液中加入过量${NaOH}$溶液并加热:${NH^{+}_{4} + OH^{-}\xlongequal{\triangle}NH_{3}\uparrow + H_{2}O}$
答案:
2.B【解析】NO₂与H₂O反应生成NO和HNO₃,离子方程式为3NO₂+H₂O=NO+2H⁺+2NO₃⁻,A错误;将SO₂通入过量冷氨水中,由于氨水过量,反应生成(NH₄)₂SO₃和水,选项所给离子方程式正确,B正确;浓硝酸和铜反应,硝酸的还原产物为NO₂,正确的离子方程式为Cu+4H⁺+2NO₃⁻=Cu²⁺+2NO₂↑+2H₂O,C错误;向NH₄HCO₃溶液中加入过量NaOH溶液并加热,氢氧根离子除了和铵根离子反应外,还会和碳酸氢根离子反应生成碳酸根离子和水,正确的离子方程式为$NH₄⁺+HCO₃⁻+2OH⁻\overset{\triangle}{=}CO₃²⁻+NH₃↑+2H₂O,$D错误。
3. 在探究某地刚落下的酸雨成分的实验中,下列根据实验现象得出的结论不正确的是(
A.在酸雨试样中加入${Ba(NO_{3})_{2}}$溶液有白色沉淀生成,不能说明酸雨中一定含${SO^{2-}_{4}}$
B.将酸雨试样浓缩后加入${Cu}$和浓硫酸,试管口有红棕色气体逸出,说明酸雨中含${NO^{-}_{3}}$
C.每隔$1\ {h}$测定酸雨试样的${pH}$,其${pH}$先变小后不变,说明刚落下的酸雨中含${H_{2}SO_{3}}$
D.用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在${Na^{+}}$
D
)A.在酸雨试样中加入${Ba(NO_{3})_{2}}$溶液有白色沉淀生成,不能说明酸雨中一定含${SO^{2-}_{4}}$
B.将酸雨试样浓缩后加入${Cu}$和浓硫酸,试管口有红棕色气体逸出,说明酸雨中含${NO^{-}_{3}}$
C.每隔$1\ {h}$测定酸雨试样的${pH}$,其${pH}$先变小后不变,说明刚落下的酸雨中含${H_{2}SO_{3}}$
D.用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在${Na^{+}}$
答案:
3.D【解析】在酸雨试样中加入Ba(NO₃)₂溶液生成白色沉淀,可能是亚硫酸根离子在酸性条件下被硝酸根离子氧化成硫酸根离子,则原溶液中不一定含有SO₄²⁻,A正确;将酸雨试样浓缩后加入Cu和浓硫酸,试管口有红棕色气体逸出,红棕色气体为NO₂,说明溶液中含有NO₃⁻,B正确;H₂SO₃被O₂氧化生成H₂SO₄,酸性增强,当H₂SO₃完全被氧化后,溶液的pH不会变化,说明酸雨中含有H₂SO₃,C正确;玻璃中含有Na元素,不能根据焰色确定酸雨中含有Na⁺,应该用铂丝或洁净无锈的铁丝做该焰色试验,D错误。
4. [陕西榆林2025高一期中]将工厂排放的烟气[含有空气,还含有少量${NO}$、${NO_{2}}$,且$n({NO})>n({NO_{2}})$]缓慢通过如图所示装置。已知:①${NO + NO_{2} + 2OH^{-}\xlongequal{}2NO^{-}_{2} + H_{2}O}$;②${2NO_{2} + 2OH^{-}\xlongequal{}NO^{-}_{3} + NO^{-}_{2} + H_{2}O}$。下列说法错误的是(
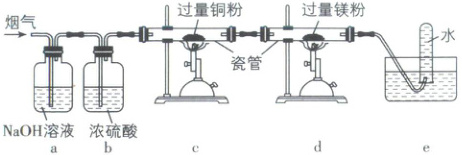
A.装置${a}$可以吸收${O_{2}}$、${NO}$、${NO_{2}}$和${CO_{2}}$
B.装置${c}$可以吸收${O_{2}}$
C.装置${d}$可以吸收${N_{2}}$
D.装置${e}$中试管收集到的气体主要是${NO}$
C
)
A.装置${a}$可以吸收${O_{2}}$、${NO}$、${NO_{2}}$和${CO_{2}}$
B.装置${c}$可以吸收${O_{2}}$
C.装置${d}$可以吸收${N_{2}}$
D.装置${e}$中试管收集到的气体主要是${NO}$
答案:
4.C【解析】装置a中是NaOH溶液,空气中的CO₂能与NaOH反应,NO和NO₂也能与NaOH发生反应①、②被吸收,过量的NO与O₂反应生成NO₂后也能被NaOH溶液吸收,A正确;装置c中是过量铜粉,加热条件下,铜能与氧气反应从而吸收氧气,B正确;N₂与镁粉反应被吸收,C正确;装置e中试管收集到的气体主要成分是稀有气体,D错误。
5. [甘肃兰州一中2024高一月考]如表所示各组物质中,物质之间通过一步反应就能实现如图所示转化的是(
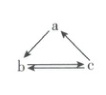
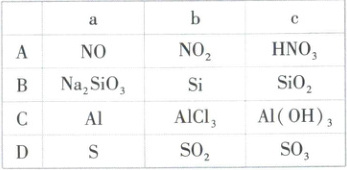
A
)

答案:
5.A【解析】NO与氧气反应生成NO₂,NO₂与水反应生成硝酸,浓硝酸与铜反应生成二氧化氮,稀硝酸与铜反应生成NO,物质之间可通过一步反应实现题图转化,A正确;Na₂SiO₃不能经一步反应生成单质硅,B错误;氢氧化铝不能经一步反应生成铝,C错误;三氧化硫不能经一步反应生成单质硫,D错误。
6. [安徽淮南二中2025高一期中]工业废碱渣的主要成分为${Na_{2}CO_{3}}$等,“水浸”后用于烟气脱硫,“吸收”含有${SO_{2}}$的烟气后得到${NaHSO_{3}}$,再经“中和”获得${Na_{2}SO_{3}}$;${Na_{2}SO_{3}}$可用于处理废水中的${Cl_{2}}$。相关过程如下:
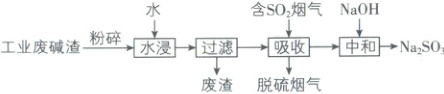
下列相关说法错误的是(
A.“水浸”前先将废碱渣粉碎可加快水浸速率
B.“吸收”后脱硫烟气中的${CO_{2}}$比“吸收”前烟气中的多
C.“中和”时反应的化学方程式为${NaOH + NaHSO_{3}\xlongequal{}Na_{2}SO_{3} + H_{2}O}$
D.向${Na_{2}SO_{3}}$溶液中滴加${BaCl_{2}}$溶液,有白色沉淀产生,说明其中含${Na_{2}SO_{4}}$

下列相关说法错误的是(
D
)A.“水浸”前先将废碱渣粉碎可加快水浸速率
B.“吸收”后脱硫烟气中的${CO_{2}}$比“吸收”前烟气中的多
C.“中和”时反应的化学方程式为${NaOH + NaHSO_{3}\xlongequal{}Na_{2}SO_{3} + H_{2}O}$
D.向${Na_{2}SO_{3}}$溶液中滴加${BaCl_{2}}$溶液,有白色沉淀产生,说明其中含${Na_{2}SO_{4}}$
答案:
6.D【解析】工业废碱渣为固态物质,“水浸”前将其粉碎可以加快水浸速率,A正确;“吸收”过程中,碳酸钠与二氧化硫反应生成亚硫酸氢钠和二氧化碳,“吸收”后脱硫烟气中的CO₂比“吸收”前烟气中的多,B正确;“中和”时的反应是“吸收”过程生成的亚硫酸氢钠与氢氧化钠反应,方程式为NaOH+NaHSO₃=Na₂SO₃+H₂O,C正确;亚硫酸钡也是白色沉淀,向Na₂SO₃溶液中滴加BaCl₂溶液,有白色沉淀产生,不能证明含有Na₂SO₄,D错误。
7. 利用空气催化氧化法除掉电石渣浆[${Ca(OH)_{2}}$]上清液中的${S^{2-}}$并制取石膏$({CaSO_{4}· 2H_{2}O})$的过程如图:
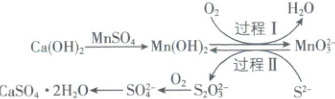
下列说法正确的是(
A.${CaSO_{4}· 2H_{2}O}$属于混合物
B.过程Ⅰ中,反应的离子方程式为${Mn(OH)_{2} + O_{2} + 2OH^{-}\xlongequal{}MnO^{2-}_{3} + 2H_{2}O}$
C.上述流程中,有两种元素的化合价发生变化
D.过程Ⅱ中,${S^{2-}}$为还原剂

下列说法正确的是(
D
)A.${CaSO_{4}· 2H_{2}O}$属于混合物
B.过程Ⅰ中,反应的离子方程式为${Mn(OH)_{2} + O_{2} + 2OH^{-}\xlongequal{}MnO^{2-}_{3} + 2H_{2}O}$
C.上述流程中,有两种元素的化合价发生变化
D.过程Ⅱ中,${S^{2-}}$为还原剂
答案:
7.D
思路导引利用空气催化氧化法除掉电石渣浆[含Ca(OH)₂]上清液中的S²⁻时,往电石渣浆中先加入MnSO₄,生成Mn(OH)₂,再通入氧气发生过程Ⅰ,O₂将Mn(OH)₂氧化生成MnO₂,同时得到H₂O;过程Ⅱ中,MnO₂将S²⁻氧化为S₂O₃²⁻,自身被还原为Mn(OH)₂,S₂O₃²⁻进一步被O₂氧化为SO₄²⁻,SO₄²⁻与溶液中的Ca²⁺结合,从而制得石膏(CaSO₄·2H₂O)。
【解析】CaSO₄·2H₂O是盐的结晶水合物,属于纯净物,A错误;过程Ⅰ中,Mn由+2价升高到+4价,O由0价降低到-2价,Mn(OH)₂是难溶物,反应的离子方程式为2Mn(OH)₂+O₂+4OH⁻=2MnO₂+4H₂O,B错误;题述流程中,Mn、O、S化合价均发生了变化,则有三种元素的化合价发生变化,C错误;过程Ⅱ中,MnO₂将S²⁻氧化为S₂O₃²⁻,自身被还原为Mn(OH)₂,S²⁻为还原剂,D正确。
思路导引利用空气催化氧化法除掉电石渣浆[含Ca(OH)₂]上清液中的S²⁻时,往电石渣浆中先加入MnSO₄,生成Mn(OH)₂,再通入氧气发生过程Ⅰ,O₂将Mn(OH)₂氧化生成MnO₂,同时得到H₂O;过程Ⅱ中,MnO₂将S²⁻氧化为S₂O₃²⁻,自身被还原为Mn(OH)₂,S₂O₃²⁻进一步被O₂氧化为SO₄²⁻,SO₄²⁻与溶液中的Ca²⁺结合,从而制得石膏(CaSO₄·2H₂O)。
【解析】CaSO₄·2H₂O是盐的结晶水合物,属于纯净物,A错误;过程Ⅰ中,Mn由+2价升高到+4价,O由0价降低到-2价,Mn(OH)₂是难溶物,反应的离子方程式为2Mn(OH)₂+O₂+4OH⁻=2MnO₂+4H₂O,B错误;题述流程中,Mn、O、S化合价均发生了变化,则有三种元素的化合价发生变化,C错误;过程Ⅱ中,MnO₂将S²⁻氧化为S₂O₃²⁻,自身被还原为Mn(OH)₂,S²⁻为还原剂,D正确。
查看更多完整答案,请扫码查看


