2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. [河南 2025·1,3 分]活字印刷术极大地促进了世界文化的交流,推动了人类文明的进步。下列“活字”字坯的主要成分为硅酸盐的是(
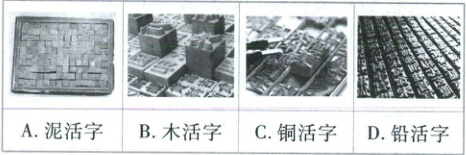
A
)
答案:
1 A【解析】泥坯的主要成分为黏土,属于硅酸盐,A 符合题意;木坯主要成分为纤维素,B 不符合题意;铜坯、铅坯均为金属材料,C、D 不符合题意。
2. [浙江 2022 年 6 月·8,2 分]下列说法不正确的是(
A.晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维
B.高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明
C.氧化铝熔点高,常用于制造耐高温材料
D.用石灰石—石膏法对燃煤烟气进行脱硫,同时可得到石膏
A
)A.晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维
B.高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明
C.氧化铝熔点高,常用于制造耐高温材料
D.用石灰石—石膏法对燃煤烟气进行脱硫,同时可得到石膏
答案:
2 A【解析】二氧化硅常用于制作光导纤维,A 错误;充有钠蒸气的高压钠灯发出的黄光射程远、透雾能力强,常用于道路照明,B 正确;氧化铝为离子化合物,熔点高,常用于制造耐高温材料,C 正确;石灰石—石膏法脱硫时发生反应:2SO₂ + 2CaCO₃ + O₂ ══ 2CaSO₄ + 2CO₂,可得到石膏的主要化学成分(CaSO₄的水合物),D 正确。
3. [河北 2024·10,3 分]图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置任选)(

C
)

答案:
3 C【解析】饱和 Na₂SO₃ 溶液和浓硫酸反应可以制 SO₂,使用固液不加热制气装置,SO₂密度比空气大,用向上排空气法收集,A 不符合题意;MnO₂和浓盐酸加热反应可以制 Cl₂,使用固液加热制气装置,Cl₂密度比空气大,用向上排空气法收集,B 不符合题意;固体 NH₄Cl 与熟石灰加热可以制 NH₃,需要使用固固加热制气装置,图中装置不合理,C 符合题意;石灰石(主要成分为 CaCO₃)和稀盐酸反应可以制 CO₂,使用固液不加热制气装置,CO₂密度比空气大,用向上排空气法收集,D 不符合题意。
4. [安徽 2025·8,3 分]下列实验产生的废液中,可能大量存在的粒子组是(
C
)
答案:
4 C【解析】NO 难溶于水,在水溶液体系中不能大量存在,A 错误;H⁺与 HSO₃⁻会发生反应:H⁺ + HSO₃⁻ ══ SO₂↑ + H₂O,无法大量共存,B 错误;反应后废液中不存在 MnO₄⁻时,生成的 MnCl₂、KCl 和剩余的 HCl 能共存,故废液中可能大量存在 H⁺、K⁺、Mn²⁺、Cl⁻,C 正确;Fe²⁺与 H₂O₂在酸性条件下会发生氧化还原反应:2Fe²⁺ + H₂O₂ + 2H⁺ ══ 2Fe³⁺ + 2H₂O,无法大量共存,D 错误。
方法技巧 在粒子共存判断中,遇到 HNO₃、KMnO₄、H₂O₂等强氧化性物质时,可以快速排查是否存在还原性物质,从而根据是否发生氧化还原反应判断粒子是否能共存。
方法技巧 在粒子共存判断中,遇到 HNO₃、KMnO₄、H₂O₂等强氧化性物质时,可以快速排查是否存在还原性物质,从而根据是否发生氧化还原反应判断粒子是否能共存。
5. [湖北 2025·8,3 分]如图所示的物质转化关系中,固体 A 与固体 B 研细后混合,常温下搅拌产生气体 C 和固体 D,温度迅速下降。气体 C 能使湿润的红色石蕊试纸变蓝。G 是一种强酸。H 是白色固体,常用作钡餐。下列叙述错误的是(
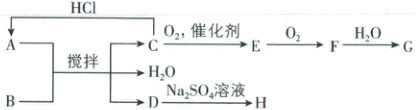
A.在 C 的水溶液中加入少量固体 A,溶液 pH 升高
B.D 为可溶于水的有毒物质
C.F 溶于雨水可形成酸雨
D.常温下可用铁制容器来盛装 G 的浓溶液
A
)
A.在 C 的水溶液中加入少量固体 A,溶液 pH 升高
B.D 为可溶于水的有毒物质
C.F 溶于雨水可形成酸雨
D.常温下可用铁制容器来盛装 G 的浓溶液
答案:
5 A
图解 由题目信息“气体 C 能使湿润的红色石蕊试纸变蓝”,可推出气体 C 为 NH₃,结合转化关系可知,E 为 NO,F 为 NO₂,G 为 HNO₃,符合题目信息“G 是一种强酸”。C 和 HCl 反应生成 A(NH₄Cl),同时 H 常用作钡餐,推出 H 为 BaSO₄,A 和 B 反应得到 D,则 D 为 BaCl₂,再由题目信息固体 A 和固体 B 研细混合,常温下搅拌反应时温度迅速下降,知 A(NH₄Cl)和 B 反应吸热,确定 B 为 Ba(OH)₂·8H₂O。
【解析】NH₄Cl 水溶液显酸性,在氨水(碱性)中加入 NH₄Cl 固体会使溶液 pH 降低,A 错误;BaCl₂(D)可溶于水,属于重金属盐,有毒,B 正确;NO₂(F)溶于水会形成硝酸型酸雨,C 正确;常温下,Fe 遇浓硝酸会钝化,故可用铁制容器盛装浓硝酸,D 正确。
关键点拨 解答无机推断题的关键是找出具有特殊性质的物质(如本题中的氨气),再结合转化关系进行正推、逆推,逐一判断,若遇到不确定的物质,可以先通读选项,从选项的设问点寻找突破口。
图解 由题目信息“气体 C 能使湿润的红色石蕊试纸变蓝”,可推出气体 C 为 NH₃,结合转化关系可知,E 为 NO,F 为 NO₂,G 为 HNO₃,符合题目信息“G 是一种强酸”。C 和 HCl 反应生成 A(NH₄Cl),同时 H 常用作钡餐,推出 H 为 BaSO₄,A 和 B 反应得到 D,则 D 为 BaCl₂,再由题目信息固体 A 和固体 B 研细混合,常温下搅拌反应时温度迅速下降,知 A(NH₄Cl)和 B 反应吸热,确定 B 为 Ba(OH)₂·8H₂O。
【解析】NH₄Cl 水溶液显酸性,在氨水(碱性)中加入 NH₄Cl 固体会使溶液 pH 降低,A 错误;BaCl₂(D)可溶于水,属于重金属盐,有毒,B 正确;NO₂(F)溶于水会形成硝酸型酸雨,C 正确;常温下,Fe 遇浓硝酸会钝化,故可用铁制容器盛装浓硝酸,D 正确。
关键点拨 解答无机推断题的关键是找出具有特殊性质的物质(如本题中的氨气),再结合转化关系进行正推、逆推,逐一判断,若遇到不确定的物质,可以先通读选项,从选项的设问点寻找突破口。
6. [广东 2025·15,4 分]按如图组装装置并进行实验:将铜丝插入溶液中,当 c 中红色褪去时,将铜丝拔离液面。下列叙述错误的是(
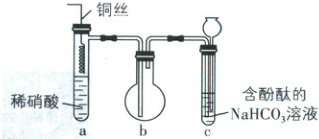
A.a 中有化合反应发生,并有颜色变化
B.b 中气体变红棕色时,所含氮氧化物至少有两种
C.c 中溶液红色刚好褪去时,${HCO^{-}_{3}}$恰好完全反应
D.若将 a 中稀硝酸换为浓硫酸并加热,则 c 中溶液颜色会褪去
C
)
A.a 中有化合反应发生,并有颜色变化
B.b 中气体变红棕色时,所含氮氧化物至少有两种
C.c 中溶液红色刚好褪去时,${HCO^{-}_{3}}$恰好完全反应
D.若将 a 中稀硝酸换为浓硫酸并加热,则 c 中溶液颜色会褪去
答案:
6 C【解析】a 中铜与稀硝酸发生反应:3Cu + 8H⁺ + 2NO₃⁻ ══ 3Cu²⁺ + 2NO↑ + 4H₂O,反应生成的 NO 极易与空气中的 O₂发生反应:2NO + O₂ ══ 2NO₂,因此 a 中有化合反应发生,且溶液由无色变为蓝色、气体由无色变为红棕色,A 正确;b 中气体变为红棕色时,b 中一定存在 NO₂,且存在平衡:2NO₂ ⇌ N₂O₄,则 b 中也一定存在 N₂O₄,所以 b 中所含氮氧化物至少有两种,B 正确;b 中的 NO₂进入 c 中,与水发生反应:3NO₂ + H₂O ══ 2HNO₃ + NO,反应生成的 HNO₃与 NaHCO₃溶液发生反应:H⁺ + HCO₃⁻ ══ H₂O + CO₂↑,因为酚酞呈粉红色的 pH 范围为 8.2~10.0,所以当溶液红色刚好褪去时,溶液 pH 约为 8.2,呈弱碱性,NaNO₃溶液呈中性,则此时溶液中还有剩余的 HCO₃⁻未反应,C 错误;若将 a 中的稀硝酸换成浓硫酸并加热,则 a 中发生反应:Cu + 2H₂SO₄(浓$) \overset{\triangle}{══} CuSO₄ + SO₂↑ + 2H₂O,$反应生成的 SO₂进入 c 中遇水生成 H₂SO₃,酸性:H₂SO₃ > H₂CO₃,则 SO₂足量时,发生反应:SO₂ + HCO₃⁻ ══ HSO₃⁻ + CO₂,即溶液中溶质为 NaHSO₃,HSO₃⁻电离程度大于水解程度,NaHSO₃溶液呈酸性,故 c 中溶液颜色会褪去,D 正确。
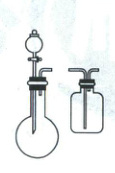
7. [北京 2019·28 改编,16 分]化学小组实验探究${SO_{2}}$与${AgNO_{3}}$溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备${SO_{2}}$,将足量${SO_{2}}$通入${AgNO_{3}}$溶液中,迅速反应,得到无色溶液 A 和白色沉淀 B。

①浓${H_{2}SO_{4}}$与 Cu 反应的化学方程式是____。
②试剂 a 是
(2)对体系中有关物质性质分析得出:沉淀 B 可能为${Ag_{2}SO_{3}}$、${Ag_{2}SO_{4}}$或二者混合物。
(资料:${Ag_{2}SO_{4}}$微溶于水;${Ag_{2}SO_{3}}$难溶于水)
实验二:验证 B 的成分

①写出${Ag_{2}SO_{3}}$溶于氨水生成${Ag(NH_{3})^{+}_{2}}$的离子方程式:
②加入盐酸后沉淀 D 大部分溶解,剩余少量沉淀 F。推断 D 中主要是${BaSO_{3}}$,进而推断 B 中含有${Ag_{2}SO_{3}}$。向滤液 E 中加入一种试剂,可进一步证实 B 中含有${Ag_{2}SO_{3}}$。所用试剂及现象是
(3)根据沉淀 F 的存在,推测${SO^{2-}_{4}}$的产生有两个途径:
途径 1:实验一中,${SO_{2}}$在${AgNO_{3}}$溶液中被氧化生成${Ag_{2}SO_{4}}$,随沉淀 B 进入 D。
途径 2:实验二中,${SO^{2-}_{3}}$被氧化为${SO^{2-}_{4}}$进入 D。
实验三:探究${SO^{2-}_{4}}$的产生途径
①向溶液 A 中滴入过量盐酸,产生白色沉淀,证明溶液中含有____;取上层清液继续滴加${BaCl_{2}}$溶液,未出现白色沉淀,可判断 B 中不含${Ag_{2}SO_{4}}$。做出判断的理由:____。
②实验三的结论:
(4)实验一中${SO_{2}}$与${AgNO_{3}}$溶液反应的离子方程式是
(5)根据物质性质分析,${SO_{2}}$与${AgNO_{3}}$溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有 Ag 和${SO^{2-}_{4}}$生成。
(6)根据上述实验所得结论:____。
(1)实验一:用如下装置(夹持、加热仪器略)制备${SO_{2}}$,将足量${SO_{2}}$通入${AgNO_{3}}$溶液中,迅速反应,得到无色溶液 A 和白色沉淀 B。

①浓${H_{2}SO_{4}}$与 Cu 反应的化学方程式是____。
②试剂 a 是
饱和 NaHSO₃溶液
。(2)对体系中有关物质性质分析得出:沉淀 B 可能为${Ag_{2}SO_{3}}$、${Ag_{2}SO_{4}}$或二者混合物。
(资料:${Ag_{2}SO_{4}}$微溶于水;${Ag_{2}SO_{3}}$难溶于水)
实验二:验证 B 的成分

①写出${Ag_{2}SO_{3}}$溶于氨水生成${Ag(NH_{3})^{+}_{2}}$的离子方程式:
Ag₂SO₃ + 4NH₃·H₂O ══ 2Ag(NH₃)₂⁺ + SO₃²⁻ + 4H₂O
。②加入盐酸后沉淀 D 大部分溶解,剩余少量沉淀 F。推断 D 中主要是${BaSO_{3}}$,进而推断 B 中含有${Ag_{2}SO_{3}}$。向滤液 E 中加入一种试剂,可进一步证实 B 中含有${Ag_{2}SO_{3}}$。所用试剂及现象是
H₂O₂溶液,产生白色沉淀
。(3)根据沉淀 F 的存在,推测${SO^{2-}_{4}}$的产生有两个途径:
途径 1:实验一中,${SO_{2}}$在${AgNO_{3}}$溶液中被氧化生成${Ag_{2}SO_{4}}$,随沉淀 B 进入 D。
途径 2:实验二中,${SO^{2-}_{3}}$被氧化为${SO^{2-}_{4}}$进入 D。
实验三:探究${SO^{2-}_{4}}$的产生途径
①向溶液 A 中滴入过量盐酸,产生白色沉淀,证明溶液中含有____;取上层清液继续滴加${BaCl_{2}}$溶液,未出现白色沉淀,可判断 B 中不含${Ag_{2}SO_{4}}$。做出判断的理由:____。
②实验三的结论:
途径 1 不产生 SO₃²⁻,途径 2 产生 SO₃²⁻
。(4)实验一中${SO_{2}}$与${AgNO_{3}}$溶液反应的离子方程式是
2Ag⁺ + SO₂ + H₂O ══ Ag₂SO₃↓ + 2H⁺
。(5)根据物质性质分析,${SO_{2}}$与${AgNO_{3}}$溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有 Ag 和${SO^{2-}_{4}}$生成。
(6)根据上述实验所得结论:____。
答案:
7
(1)①Cu + 2H₂SO₄(浓$) \overset{\triangle}{══} CuSO₄ + SO₂↑ + 2H₂O$
②饱和 NaHSO₃溶液
(2)①Ag₂SO₃ + 4NH₃·H₂O ══ 2Ag(NH₃)₂⁺ + SO₃²⁻ + 4H₂O
②H₂O₂溶液,产生白色沉淀
(3)①Ag⁺ Ag₂SO₃溶解度大于 BaSO₄,没有 BaSO₄沉淀时,必定没有 Ag₂SO₃。②途径 1 不产生 SO₃²⁻,途径 2 产生 SO₃²⁻
(4)2Ag⁺ + SO₂ + H₂O ══ Ag₂SO₃↓ + 2H⁺
(6)实验条件下:SO₂与 AgNO₃溶液生成 Ag₂SO₃的速率大于生成 Ag 和 SO₃²⁻的速率;碱性溶液中 SO₃²⁻更易被氧化为 SO₄²⁻
【解析】
(1)①实验室利用浓 H₂SO₄与 Cu 片在加热条件下反应制取 SO₂,化学方程式为 Cu + 2H₂SO₄(浓$) \overset{\triangle}{══} CuSO₄ + SO₂↑ + 2H₂O。$②试剂 a 是饱和 NaHSO₃溶液,用于观察气体流速,且 SO₂在饱和 NaHSO₃溶液中溶解度很小,可防止发生倒吸。
(2)①Ag₂SO₃溶于氨水生成 Ag(NH₃)₂⁺,离子方程式为 Ag₂SO₃ + 4NH₃·H₂O ══ 2Ag(NH₃)₂⁺ + SO₃²⁻ + 4H₂O。
②沉淀 D 洗涤干净后,加入过量稀盐酸,BaSO₃与稀盐酸反应生成 BaCl₂、SO₂和 H₂O,则滤液 E 中含有 BaCl₂和溶解在水中的 SO₂形成的 H₂SO₃,可向 E 中加入 H₂O₂溶液,H₂O₂将 H₂SO₃氧化生成 SO₄²⁻,SO₄²⁻和 Ba²⁺反应产生 BaSO₄白色沉淀,进一步证实 B 中含有 Ag₂SO₃。
(3)向溶液 A 中滴入过量盐酸,产生白色沉淀,该沉淀为 AgCl,证明溶液 A 中含有 Ag⁺;取上层清液继续滴加 BaCl₂溶液,未出现白色沉淀,证明溶液 A 不含 SO₄²⁻,由于 Ag₂SO₃微溶于水,则 B 中不含 Ag₂SO₃,从而确定途径 1 不产生 SO₃²⁻,途径 2 产生 SO₃²⁻。
(4)由
(3)推知,实验一中 SO₂与 AgNO₃溶液反应生成 Ag₂SO₃,离子方程式为 2Ag⁺ + SO₂ + H₂O ══ Ag₂SO₃↓ + 2H⁺。
(6)对比分析
(4)
(5)可知,SO₂与 AgNO₃溶液反应生成 Ag₂SO₃的速率大于生成 Ag 和 SO₃²⁻的速率,再结合实验二可知,碱性溶液中 SO₃²⁻更易被氧化为 SO₄²⁻。
(1)①Cu + 2H₂SO₄(浓$) \overset{\triangle}{══} CuSO₄ + SO₂↑ + 2H₂O$
②饱和 NaHSO₃溶液
(2)①Ag₂SO₃ + 4NH₃·H₂O ══ 2Ag(NH₃)₂⁺ + SO₃²⁻ + 4H₂O
②H₂O₂溶液,产生白色沉淀
(3)①Ag⁺ Ag₂SO₃溶解度大于 BaSO₄,没有 BaSO₄沉淀时,必定没有 Ag₂SO₃。②途径 1 不产生 SO₃²⁻,途径 2 产生 SO₃²⁻
(4)2Ag⁺ + SO₂ + H₂O ══ Ag₂SO₃↓ + 2H⁺
(6)实验条件下:SO₂与 AgNO₃溶液生成 Ag₂SO₃的速率大于生成 Ag 和 SO₃²⁻的速率;碱性溶液中 SO₃²⁻更易被氧化为 SO₄²⁻
【解析】
(1)①实验室利用浓 H₂SO₄与 Cu 片在加热条件下反应制取 SO₂,化学方程式为 Cu + 2H₂SO₄(浓$) \overset{\triangle}{══} CuSO₄ + SO₂↑ + 2H₂O。$②试剂 a 是饱和 NaHSO₃溶液,用于观察气体流速,且 SO₂在饱和 NaHSO₃溶液中溶解度很小,可防止发生倒吸。
(2)①Ag₂SO₃溶于氨水生成 Ag(NH₃)₂⁺,离子方程式为 Ag₂SO₃ + 4NH₃·H₂O ══ 2Ag(NH₃)₂⁺ + SO₃²⁻ + 4H₂O。
②沉淀 D 洗涤干净后,加入过量稀盐酸,BaSO₃与稀盐酸反应生成 BaCl₂、SO₂和 H₂O,则滤液 E 中含有 BaCl₂和溶解在水中的 SO₂形成的 H₂SO₃,可向 E 中加入 H₂O₂溶液,H₂O₂将 H₂SO₃氧化生成 SO₄²⁻,SO₄²⁻和 Ba²⁺反应产生 BaSO₄白色沉淀,进一步证实 B 中含有 Ag₂SO₃。
(3)向溶液 A 中滴入过量盐酸,产生白色沉淀,该沉淀为 AgCl,证明溶液 A 中含有 Ag⁺;取上层清液继续滴加 BaCl₂溶液,未出现白色沉淀,证明溶液 A 不含 SO₄²⁻,由于 Ag₂SO₃微溶于水,则 B 中不含 Ag₂SO₃,从而确定途径 1 不产生 SO₃²⁻,途径 2 产生 SO₃²⁻。
(4)由
(3)推知,实验一中 SO₂与 AgNO₃溶液反应生成 Ag₂SO₃,离子方程式为 2Ag⁺ + SO₂ + H₂O ══ Ag₂SO₃↓ + 2H⁺。
(6)对比分析
(4)
(5)可知,SO₂与 AgNO₃溶液反应生成 Ag₂SO₃的速率大于生成 Ag 和 SO₃²⁻的速率,再结合实验二可知,碱性溶液中 SO₃²⁻更易被氧化为 SO₄²⁻。
查看更多完整答案,请扫码查看


