2026年高中必刷题高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高中必刷题高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 重晶石的主要成分是${BaSO_{4}}$,我国学者以重晶石为原料设计${BaCl_{2}}$晶体和羰基硫的联合生产以实现节能减排,其工艺流程如下所示。下列说法中不正确的是(
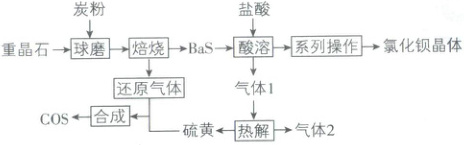
A.“球磨”的作用是增大反应物的接触面积,加快反应速率
B.“还原气体”为${CO}$,“气体 2”为${H_{2}}$
C.“酸溶”过程可用硝酸代替盐酸
D.获得氯化钡晶体的操作中需用到玻璃棒
C
)
A.“球磨”的作用是增大反应物的接触面积,加快反应速率
B.“还原气体”为${CO}$,“气体 2”为${H_{2}}$
C.“酸溶”过程可用硝酸代替盐酸
D.获得氯化钡晶体的操作中需用到玻璃棒
答案:
1 C【解析】“球磨”的作用是增大固体反应物的接触面积,加快反应速率,A 正确;由流程图可知,BaSO₄和炭粉发生反应生成 BaS 和“还原气体”,根据元素守恒及气体具有还原性可推知,“还原气体”为 CO;向生成的 BaS 中加入盐酸进行“酸溶”,可发生反应 BaS + 2HCl ══ BaCl₂ + H₂S↑,故“气体 1”为 H₂S,“热解”过程中 H₂S 分解生成硫黄和氢气,故“气体 2”为 H₂,B 正确;由于硝酸具有强氧化性,能将 -2 价 S 氧化至 +6 价,与钡离子结合生成硫酸钡,无法制得氯化钡晶体和硫黄,故“酸溶”过程不可用硝酸代替盐酸,C 错误;通过蒸发浓缩、冷却结晶的方法可从溶液中得到氯化钡晶体,蒸发浓缩的过程中需要使用玻璃棒不断搅拌,D 正确。
2. 亚硝酸钠(${NaNO_{2}}$)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组设计了如图所示装置制备${NaNO_{2}}$(A 中加热装置已略去)。
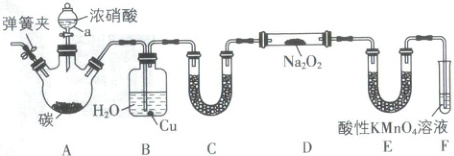
查阅资料:1. ${2NO + Na_{2}O_{2}\xlongequal{}2NaNO_{2}}$;
2. NO 可被${KMnO_{4}(H^{+})}$氧化为${NO^{-}_{3}}$。
回答下列问题:
(1)A 中发生反应的化学方程式为____,体现了浓硝酸的____(填“酸性”“强氧化性”或“酸性和强氧化性”)。
(2)装置 B 的作用为
(3)装置 C 中的试剂为
(4)装置 E 的作用为
(5)F 中发生反应的离子方程式为____。

查阅资料:1. ${2NO + Na_{2}O_{2}\xlongequal{}2NaNO_{2}}$;
2. NO 可被${KMnO_{4}(H^{+})}$氧化为${NO^{-}_{3}}$。
回答下列问题:
(1)A 中发生反应的化学方程式为____,体现了浓硝酸的____(填“酸性”“强氧化性”或“酸性和强氧化性”)。
(2)装置 B 的作用为
吸收挥发出的 NO₂,并将 NO₂转化为 NO
。(3)装置 C 中的试剂为
碱石灰
。(4)装置 E 的作用为
防止后续装置中的水进入装置 D 而使制得的亚硝酸钠不纯
。(5)F 中发生反应的离子方程式为____。
答案:
2
(1)C + 4HNO₃(浓$) \overset{\triangle}{══} CO₂↑ + 4NO₂↑ + 2H₂O $强氧化性
(2)吸收挥发出的 NO₂,并将 NO₂转化为 NO
(3)碱石灰
(4)防止后续装置中的水进入装置 D 而使制得的亚硝酸钠不纯
(5)5NO + 3MnO₄⁻ + 4H⁺ ══ 3Mn²⁺ + 5NO₃⁻ + 2H₂O
【解析】
(1)由题图可知,装置 A 中碳与浓硝酸在加热的条件下发生反应,其反应的化学方程式为 C + 4HNO₃(浓$) \overset{\triangle}{══} CO₂↑ + 4NO₂↑ + 2H₂O,$由于 HNO₃中的 N 全部由 +5 价转化为 +4 价,故浓硝酸只体现强氧化性。
(2)由资料 1 可知,NO 与过氧化钠反应可生成亚硝酸钠,故装置 B 的作用为吸收挥发出的 NO₂,并将 NO₂转化为 NO。
(3)为防止 NO 中混有的水蒸气和二氧化碳与过氧化钠发生反应而影响亚硝酸钠的纯度,需将水蒸气与二氧化碳除去,故装置 C 中盛放的试剂为碱石灰。
(4)装置 E 的作用为防止后续装置中的水进入装置 D 而使制得的亚硝酸钠不纯。
(5)根据资料 2 所给信息及原子守恒、得失电子守恒和电荷守恒可得,F 中发生反应的离子方程式为 5NO + 3MnO₄⁻ + 4H⁺ ══ 3Mn²⁺ + 5NO₃⁻ + 2H₂O。
(1)C + 4HNO₃(浓$) \overset{\triangle}{══} CO₂↑ + 4NO₂↑ + 2H₂O $强氧化性
(2)吸收挥发出的 NO₂,并将 NO₂转化为 NO
(3)碱石灰
(4)防止后续装置中的水进入装置 D 而使制得的亚硝酸钠不纯
(5)5NO + 3MnO₄⁻ + 4H⁺ ══ 3Mn²⁺ + 5NO₃⁻ + 2H₂O
【解析】
(1)由题图可知,装置 A 中碳与浓硝酸在加热的条件下发生反应,其反应的化学方程式为 C + 4HNO₃(浓$) \overset{\triangle}{══} CO₂↑ + 4NO₂↑ + 2H₂O,$由于 HNO₃中的 N 全部由 +5 价转化为 +4 价,故浓硝酸只体现强氧化性。
(2)由资料 1 可知,NO 与过氧化钠反应可生成亚硝酸钠,故装置 B 的作用为吸收挥发出的 NO₂,并将 NO₂转化为 NO。
(3)为防止 NO 中混有的水蒸气和二氧化碳与过氧化钠发生反应而影响亚硝酸钠的纯度,需将水蒸气与二氧化碳除去,故装置 C 中盛放的试剂为碱石灰。
(4)装置 E 的作用为防止后续装置中的水进入装置 D 而使制得的亚硝酸钠不纯。
(5)根据资料 2 所给信息及原子守恒、得失电子守恒和电荷守恒可得,F 中发生反应的离子方程式为 5NO + 3MnO₄⁻ + 4H⁺ ══ 3Mn²⁺ + 5NO₃⁻ + 2H₂O。
查看更多完整答案,请扫码查看


